 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Лабораторная работа №3. «Определение анионного состава воды: концентрации нитрат-
«Определение анионного состава воды: концентрации нитрат-, гидрокарбонат-, карбонат- и гидрат-ионов»
Аппаратура, посуда и реактивы: · Колориметр фотоэлектрический концентрационный любого типа (λ=410 нм). · Баня водяная ТУ 10-23-103-88. · Чашки выпарные фарфоровые ГОСТ 9147-80Е. · Пипетки по ГОСТ 29227-91 вместимостью 2 и 10 см3. · Цилиндр мерный по ГОСТ 1770-74 вместимостью 25 см3. · Колба мерная по ГОСТ 1770-74 вместимостью 50 см3. · Аммиак водный по ГОСТ 3760-79, раствор разбавленный водой в объемном отношении 1:10. · Кислота серная концентрированная по ГОСТ 4204-77. · Кислота салициловая, готовят спиртовый раствор с массовой долей салициловой кислоты 1%. · Спирт этиловый ректификационный по ГОСТ 18300-87. · Натрий гидроксид по ГОСТ 4328-77 и калий-натрий виннокислый 4-водный (Сегнетовая соль) по ГОСТ 5845-79, из 400 г гидроксида натрия и 60 г Сегнетовой соли готовят 1 дм3раствора. · Вода дистиллированная по ГОСТ 6709-72.
Выполнение анализа: Отобрали 5 см3 отфильтрованной пробы, прибавили 2 см3 раствора салициловой кислоты и выпарили досуха в фарфоровой чашке на водяной бане. После охлаждения сухой остаток перемешали с 2 см3 и оставили на 10 мин. Затем к содержимому чашки ОЧЕНЬ ОСТОРОЖНО, ПО КАПЛЯМ прибавили 10-15 см3 дистиллированной воды, после этого также ОЧЕНЬ ОСТОРОЖНО, ПО КАПЛЯМ прилили примерно 15 см3 раствора гидроксида натрия и Сегнетовой соли и все содержимое чашки количественно перенесли в мерную колбу вместимостью 50 см3. Стенки чашки обмыли дистиллированной водой, колбу охладили в холодной воде до комнатной температуры и довели дистиллированной водой до метки. Полученный окрашенный раствор сразу же фотометрировали при λ=410 нм в кюветах с толщиной слоя 2 см. В качестве раствора сравнения использовали холостой раствор. Вычисление результатов: Массовую концентрацию нитрат-ионов, (Х), мг/дм3, вычислили по формуле
где С – масса нитрат-ионов, найденная по калибровочному графику, мг; V – объем исследуемой пробы, взятый на анализ, см3; 1000 – коэффициент пересчета см3 в дм3.
Х= Вывод: проделав данный опыт, мы определили массовую концентрацию нитрат-ионов.
3.2. Определение массовой концентрации гидрокарбонат-, карбонат и гидрат-ионов. (Определение щелочности воды) Посуда и реактивы: · Колба мерная по ГОСТ 1770-74 вместимостью 100 см3. · Бюретка по ГОСТ 29251-91 вместимостью 25 см3. · Колба коническая по ГОСТ 25336-82 вместимостью 250 см3. · Капельницы по ГОСТ 25336-82 · Кислота соляная по ГОСТ 3118-77, раствор молярной концентрации 0,1 моль/дм3. · Фенолфталеин (индикатор) по ТУ 6-09-5360-88, спиртовый раствор с массовой долей 0,1%, готовят по ГОСТ 4919.1-77. · Метиловый оранжевый (индикатор) по ТУ 6-09-5177-84, спиртовый раствор с массовой долей 0,1%, готовят по ГОСТ 4919.1-77. Выполнение анализа: 100 см3 исследуемой воды перелили из мерной колбы в коническую колбу вместимостью 250 см3, прибавили 5 капель раствора фенолфталеина и титровали раствором соляной кислоты до обесцвечивания окраски. Затем в эту же колбу прибавили 3 капли раствора метилового оранжевого и титровали раствором соляной кислоты до перехода окраски из желтой в слаборозовую. Обработка результатов: Титрование:
Концентрацию карбонатных ионов [CO32-], мг-экв/дм3 (карбонатную щелочность) вычислили по формуле:
где V1 – объем раствора соляной кислоты молярной концентрации 0,1 моль/дм3, израсходованный на титрование с фенолфталеином, см3; 0,1 – коэффициент, учитывающий молярность раствора соляной кислоты; К – поправочный коэффициент раствора соляной кислоты молярной концентрации 0,1 моль/дм3; V – объем пробы, взятой на анализ, см3; 1000 – коэффициент пересчета см3 в дм3.
Концентрацию гидрокарбонатных ионов [HCO3-], мг-экв/дм3, (гидрокарбонатную щелочность) вычислили по формуле
где V2 – общий объем раствора соляной кислоты концентрации 0,1 моль/дм3, израсходованный на титрование с фенолфталеином и метиловым оранжевым; V1 – объем раствора соляной кислоты концентрации 0,1 моль/дм3, израсходованный на титрование с фенолфталеином, см3; V – объем пробы, взятой на анализ, см3.
При 2V1 < V2 гидратная щелочность отсутствует.
Общая щелочность воды равна сумме карбонатной, гидрокарбонатной и гидратной щелочности:
Вывод: Проделав данную лабораторную работу мы определили массовую концентрацию гидрокарбонат- карбонат и гидрат- ионов.
Поиск по сайту: |



 =1,66 мг-экв/дм3
=1,66 мг-экв/дм3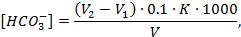
 =3,32
=3,32
 =3,92
=3,92