 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Лабораторная работа №2. Лабораторная работа №1Стр 1 из 3Следующая ⇒
Лабораторная работа №1 «Определение содержания сухого остатка(общей минерализации)» Аппаратура и посуда: · Весы лабораторные по ГОСТ 24104- 80 2-го класса точности. · Шкаф сушильный с терморегулятором, · Колба мерная по РОСТ 1770-74 вместимостью 100 см3. · Чашка выпарительная вместимостью 150 см3. · Индикаторы по ГОСТ 25336-32 · Бумага фильтровальная по ГОСТ12026-76 Проведение анализа: Выпарительную чашку довели до постоянной массы при температуре 120 °С. Затем в чашку налили 50 см3 предварительно отфильтрованной пробы исследуемой воды и проводили выпаривание воды при 90-95 °С в сушильном шкафу с принудительной циркуляцией воздуха. Полученный сухой остаток довели до постоянной массы при 110°С. Обработка результатов Концентрацию сухого остатка (X), мг/дм3, вычислили по формуле
где М - масса чашки с сухим остатком (61,4320) мг; М1 - масса пустой чашки (61,370) мг; V- объем воды, взятый на анализ (50) см3.
Вывод: Природные воды в первую очередь классифицируются на основе различия в общем количестве растворенных неорганических и частично органических веществ. В полученных образцах общее количество растворенных веществ (общую минерализацию) определяют по массе сухого остатка предварительно отфильтрованной и выпаренной пробы. Проделав данную лабораторную работу, мы определили концентрацию сухого остатка.
Лабораторная работа №2 «Определение анионного состава воды: концентрации хлорид- и сульфат ионов» 2.1 Определение массовой концентрации хлорид-ионов Посуда и реактивы: · Колба мерная по ГОСТ 1770-74 вместимостью 100 см3. · Бюретка по ГОСТ 29251-91 вместимостью 25 см3. · Колба коническая по ГОСТ 25336-82 вместимостью 250 см3. · Капельницы по ГОСТ 25336-82. · Нитрат ртути (II) по ГОСТ 4520-78. Раствор молярной концентрации 0.05 моль/дм3. · Азотная кислота по ГОСТ 4461-77, не содержащая оксидов азота, концентрированная, плотностью 1300 кг/м3. · Дифенилкарбазон (индикатор) по ТУ 6-9-5215-85, спиртовый раствор с массовой долей 0,1 %. Готовят по ГОСТ 4919.1-77. Раствор хранят в темной склянке.
Проведение анализа: 50 см3 исследуемой воды перелили из мерной колбы в коническую колбу вместимостью 250 см3. В колбу добавили 3-4 капли концентрированной азотной кислоты и 2 см3 раствора дифенилкарбазона, затем титровали раствором нитрата ртути (II) до получения сине-фиолетовой окраски. Обработка результатов:
Титрование:
Массовую концентрацию ионов хлора (X), г/дм3, вычислили по формуле
где V - объем раствора нитрата ртути (II) молярной концентрации 0,05 моль/дм3, израсходованный на титрование (1,53) см3. К - поправочный коэффициент раствора нитрата ртути (II) молярной концентрацией 0,05 моль/дм3 (1,02). 0,001772 - масса ионов хлора, эквивалентная 1 см3 раствора нитрата ртути (II) молярной концентрации 0,05 моль/дм3, г. 50 - объем пробы воды, взятой на анализ, см3. 1000 - коэффициент пересчета см3 в дм3.
Х= Вывод: Проделав эту лабораторную работу, мы определили массовую концентрацию ионов хлора меркурииметрическим методом, который основан на титровании хлоридов в кислой среде раствором нитрата ртути(II) в присутствии индикатора дифенилкарбазона. 2.2 Определение массовой концентрации сульфат-ионов Аппаратура. Посуда и реактивы: · Колориметр фотоэлектрический концентрационный любого типа (λ = 315 нм). · Пипетки по ГОСТ 29227-91 вместимостью 5см3, · Колбы конические по ГОСТ 25336-82 вместимостью 25 см3. · Капельница по ГОСТ 25336-82 . · Кислота соляная по ГОСТ 3118-77, раствор разбавленный водой в объемном отношении 1:1 . · Хлорид бария по ГОСТ 4108-72, готовят раствор с массовой долей ВаСl2 - 5 %. · Глицерин по ГОСТ 6259-75. · Спирт этиловый ректификационный по ГОСТ 18300-87. Выполнение анализа: Пипеткой отобрали 5 см3 исследуемой воды и перенесли в коническую колбу вместимостью 25 см3, добавили 1-2 капли раствора соляной кислоты и 5 см3 смешанного реактива. Содержимое колбы тщательно перемешали. Таким же образом приготовили холостую пробу на дистиллированной воде. Через 40 минут измерили оптическую плотность исследуемой воды и холостой пробы на фотоэлектроколориметре (λ = 315 нм, υ = 31430 см-1) в кюветах с толщиной слоя 2 см. Расчетная величина оптической плотности равна разности оптических плотностей холостой пробы и исследуемой воды.
Вычисление результата измерений: Оптическая плотность исследуемой воды равна: 68,7. Оптическая плотность холостой пробы равна: 75,7. Расчетная величина оптической плотности равна: 75,7-68,7=7 Концентрацию сульфат-ионов определили с помощью графика, на оси абсцисс которого отложена концентрация сульфат-ионов, а на оси ординат - соответствующая оптическая плотность. Концентрацию сульфат-ионов в мг/дм3 нашли по формуле Сх = С0 ∙ П, где С0 - концентрация сульфат-ионов, найденная по градуировочной характеристике, мг/дм3; П - степень разбавления исходной пробы воды (в случае, если исходную пробу не разбавляли, П = 1). С=0,049 мг.
Вывод: Проделав эту работу мы определили массовую концентрацию сульфат-ионов, которая составила 0,049 мг
Поиск по сайту: |
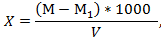
 =1,24
=1,24

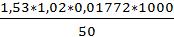 =0,542232 г/
=0,542232 г/ 