 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Нейтрализация и гидролиз ⇐ ПредыдущаяСтр 4 из 4
Реакция нейтрализации между сильной кислотой и сильным основанием, обычно характеризуется отрицательной энтальпией (значительным тепловыделением), отрицательной энергией Гиббса и имеет высокую степень завершенности.
ΔrGo(298) = Σνi Δf Goi(298) = -80,3 ккал/моль Ионы сильных кислоты, основания и растворимой соли К+ и NO3− при почти полной, а потому одинаковой степени диссоциации (α → 1) не претерпевают изменений, а потому могут быть сокращены К+ + OH − + H+ + NO3− = K+ + NO3− + H2O → H+ + OH− = H2O и сущность реакции нейтрализации сводится к образованию воды из H+ и OH−, входивших в состав реагентов. Полученный раствор имеет нейтральную реакцию (pH ≈ 7) и добавление воды, ничего не меняя с химической точки зрения, приводит только к разбавлению раствора образующейся соли. Реакции нейтрализации, в которых хотя бы один из реагентов является слабым электролитом, не доходят до завершения, а потому при добавлении воды и изменении внешних условий возможно протекание обратной реакции. Т.о. реакции солей с водой, обратные нейтрализации кислот и оснований называются реакциями гидролиза солей. В более широком смысле это взаимодействие вещества с составными частями воды. 1. Гидролиз солей, образованных катионами сильных оснований и анионами слабых кислот (K2CO3, K2S, …). CH3(CO)ONa + H2O = CH3(CO)OH + NaOH (молекулярная форма), CH3(CO)O− + H2O = CH3(CO)OH + OH− (ионная форма). Кгидр= [CH3(CO)OH] [OH−]/[CH3(CO)O−] · ([H+] / [H+]) = KW / Ka . Константа гидролиза, определяющая равновесную степень гидролиза соли выражается через ионное произведение воды и константу ионизации кислоты. Чем слабее образующаяся при гидролизе кислота, тем сильнее гидролиз ее солей. 2. Гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты (CuCl2, AlCl3, Al2(SO4)3, …) рассмотрим на примере гидролиза NH4Cl. NH4+ + H2O = NH4OH + H+ Кгидр = [NH4OH] [H+]/[NH4+] · [OH−]/[OH−] = KW / Kb 3. Соли слабой кислоты и слабого основания (Al2S3, Al(COO)3, Fe(CH3COO)3, …) легче других подвергаются гидролизу, т.к. их ионы связывают одновременно оба иона воды и образуют слабые электролиты. NH4+ + CH3(CO)O− + H2O = NH4OH + CH3 (CO)OH Кгидр = [NH4OH]·[CH3(CO)OH] / [CH3(CO)O−] [NH4+] = KW/(Ka ·Kb).
Пример:Найти pH раствора HCN, С=1 М. (pKa = 4.74 из табл. 4.1) CN− + H2O = HCN + OH− A− + H2O = HА + OH− Кгидр = [HA]·[OH−] / [A−] = KW / Ka; C – x x x pH = 7+ 0,5·pKa – 0,5 pC = 7 + 0,5·9,4 - 0,5·0 = 11,7.
Ступенчатый гидролиз 1.Соль, содержащая многовалентный катион слабого основания 1-я ступень: CuCl2 + H2O = CuOHCl + HCl, Cu2+ + H2O = CuOH+ + H+, хлорид гидроксомеди (II) 2-я ступень: CuOHCl + H2O = Cu(OH)2 + HCl, CuOH+ + H2O = Cu(OH)2 + H+. Реакция среды – кислая, pH < 7. Гидролиз по второй ступени протекает в весьма малой степени. 2. Соль, содержащая анион слабой многоосновной кислоты и катион сильного основания. Na2S + H2O = NaHS + NaOH S2- + H2O = HS− + OH− NaHS + H2O = NaOH + H2S HS− + H2O = OH− + H2S. Реакция среды – щелочная, pH>7. Особые случаи гидролиза PCl3, PCl5, PBr3, SO2Cl2 и других солей, которые часто идут до конца с образованием двух кислот, например: PBr3 + 3H2O = 3HBr + H3PO4 SO2Cl2 + 2H2O = 2HCl + H2SO4 Гидролиз органических соединений широко используется для промышленного получения спиртов (этилового), альдегидов, кетонов, карбоновых кислот и др. R – Hal + H2O = ROH + H+ + Hal−; R−C=O OR' + H2O = R−C=O OH + R'OH; и т. д. По аналогии со степенью диссоциации может быть введена и рассчитана степень гидролиза h с параллельным расчетом рН среды. Несколько таких примеров представлено ниже. 1) NH4Cl: h = 0,007%, рН = 5,3; 2) СН3(СО)О NH4: h = 0,5%, рН = 7,0; 3) КСN: h = 1,2%, рН = 11,3; 4) Na3 PO4: h = 34%, рН = 12…
Поиск по сайту: |

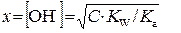 ,
, 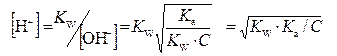 .
.