|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Получение и устойчивость дисперсных систем ⇐ ПредыдущаяСтр 3 из 3
Дисперсные системы могут быть получены двумя принципиально противоположными методами: дроблением макрообъектов (подход «сверху-вниз», «top-down») и физической или химической конденсацией микрообъектов – атомов, молекул, ионов (подход «снизу-вверх», «bottom-up method»). В нанотехнологиях широко используют конденсационные методы синтеза наночастиц (технологии «снизу-вверх»), где различают физическую и химическую конденсацию. Основными требованиями при получении коллоидных наносистем являются: малая растворимость дисперсной фазы в дисперсионной среде, создание условий, при которых ограничен рост образующихся частиц, и наличие в системе веществ, способных их стабилизировать. Если этого нет, то происходит постепенное самопроизвольное слияние мелких капель в туманах, дождевых облаках и эмульсиях, агрегация твердых высокодисперсных частиц. Все это приводит к разрушению дисперсных систем: туманы и дождевые облака проливаются дождем, эмульсии расслаиваются, коллоидные растворы коагулируют с образованием осадков. Химическая конденсация – это объединение атомов, молекул или ионов с образованием частиц дисперсной фазы в результате протекания химических реакций. Такими реакциями могут быть реакции гидролиза, окисления-восстановления и ионного обмена, в которых образуются коллоидные растворы (золи) малорастворимых солей и гидроксидов. При смешении растворов реагентов должен образоваться пересыщенный раствор малорастворимого вещества, что является обязательным условием образования зародышей новой фазы. Необходимые ограничения для роста зародышей достигаются, например, при добавлении концентрированного раствора одного из компонентов к разбавленному раствору другого при интенсивном перемешивании, а имеющийся избыток первого реагента выступает в роли стабилизатора дисперсной фазы, обеспечивающего появление на поверхности зародышей электрического заряда. Рассмотрим образование золя иодида серебра по реакции ионного обмена AgNO3 + KI ®AgI¯ + KNO3 при условии, например, избытка нитрата серебра (стабилизатор), и строение частиц дисперсной фазы (их называют мицеллами). Молекулы AgI образуют мельчайшие аморфные зародыши дисперсной фазы – кластеры (ранее их называли агрегатами молекул) [mAgI], которые адсорбируют на своей поверхности родственные по составу ионы стабилизатора – в данном случае ионы Ag+, в результате чего поверхность зародыша приобретает положительный заряд и возникает ядро мицеллы [mAgI]∙nAg+. За счет кулоновских сил притяжения на поверхности ядра прочно удерживается некоторое число противоионов стабилизатора (n – x) NO3–, которые частично нейтрализуют поверхностный заряд (плотный слой противоионов) – возникает положительно заряженная коллоидная частица или гранула: {[mAgI]∙nAg+∙(n-x)NO3–}x+. Полная нейтрализация поверхностного заряда происходит за счет избыточного количества противоионов NO3– по сравнению с количеством коионов К+ и Ag+, находящихся в приповерхностном слое раствора (диффузный слой), – возникает электронейтральная мицелла: {[mAgI]∙n Ag+∙(n-x)NO3–}x+∙xNO3–.
Рисунок 4 – Мицелла положительно заряженного золя йодида серебра
Говорят, что получен положительно заряженный золь иодида серебра, где ионы Ag+ и NO3– образуют вдоль поверхности двойной электрический слой (ДЭС), ионы Ag+ называют потенциалопределяющими, а ионы NO3– – противоионами плотной и диффузной частей ДЭС соответственно (рисунок 4). Аналогичным образом при избытке иодида калия можно получить отрицательно заряженный золь иодида серебра: {[mAgI] nI– (n-x) K+}x–∙xK+. Золи малорастворимых гидроксидов металлов обычно получают по реакции контролируемого гидролиза, например, при постепенном подщелачивании водного раствора соли этого металла раствором аммиака. Механизм образования наночастиц носит более сложный характер и протекает в несколько стадий:
Классическим примером использования реакции гидролиза может служить получение гидрозоля гидроксида железа (III). Если несколько капель концентрированного раствора FeCl3 влить в стакан с кипящей дистиллированной водой, то в стакане распространяется облако красно-коричневого цвета, а при размешивании раствор приобретает окраску крепкого чая. В этих условиях равновесие в эндотермическом процессе гидролиза FeCl3 + 3 Н2О → Fе(ОН)3↓ + 3 НСl сдвинуто вправо, в сторону образования нерастворимого гидроксида железа (III). Зародыши дисперсной фазы [mFе(ОН)3] адсорбируют из раствора потенциалопределяющие ионы Fe3+, образуя ядро [mFe(OH)3] nFe3+, на поверхности которого формируется плотный и диффузный слой из противоионов Сl– – образуется положительно заряженный золь гидроксида железа (III), мицеллы которого формально можно записать в виде: {[mFe(OH)3] nFe3+ 3(n-x) Сl–}3x+∙3xСl–.
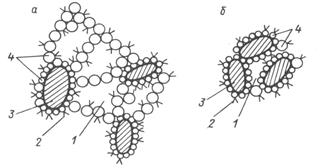
Золи могут существовать достаточно длительное время, благодаря участию мицелл в броуновском движении молекул раствора и одинаковому электрическому заряду коллоидных частиц (электростатический фактор устойчивости), препятствующему их укрупнению в результате слипания (коагуляции). В этом случае говорят, что золи агрегативно устойчивы. Устойчивость лиофобных золей можно дополнительно повысить, если в образовавшуюся дисперсную систему добавить коллоидные ПАВ или водорастворимые ВМС (например, водный раствор желатины), которые формируют на поверхности частиц защитные адсорбционные слои (структурно-механический фактор устойчивости). Этот эффект называется коллоидной защитой. Разрушение дисперсной системы всегда связано с потерей ею агрегативной устойчивости в результате укрупнения частиц дисперсной фазы при их слипании – этот процесс называется коагуляцией (слияние мелких капель эмульсий – коалесценцией). В результате коагуляции система становится грубодисперсной и внешне это сопровождается появлением мути, изменением окраски коллоидных растворов и, наконец, образованием осадка. Оседание грубодисперсных твердых частиц называется седиментацией.Коагуляция может наступить в результате разного рода внешних воздействий на коллоидную систему – к физическим методам воздействия относят изменение температуры, механическое воздействие (размешивание или встряхивание), воздействие электрического поля и др., но более эффективным является химическое воздействие – добавки растворов индифферентных сильных электролитов – коагулянтов, которые нарушают электростатический фактор устойчивости золя. Согласно эмпирическому правилу Шульце-Гарди, коагулирующим действием обладает тот ион вводимого коагулянта, заряд которого противоположен по знаку заряду коллоидной частицы (отрицательно заряженный золь коагулируют катионы, положительно – анионы), а эффективность процесса коагуляции существенно зависит от величины заряда этого иона. Наименьшая молярная концентрация иона-коагулянта в коллоидном растворе Ск, при которой наблюдаются видимые признаки коагуляции, называется порогом коагуляции, а обратная величина 1/Ск – коагулирующей способностью. Порог коагуляции определяют опытным путем для конкретной дисперсной системы. Для простейшей модельной системы теоретически было показано (Б.В. Дерягин, теория ДЛФО), что порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона Х±n (закон 6-ой степени Дерягина):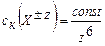 и отношение и отношение  (8) (8) Этот результат приблизительно соответствует соотношению между пороговыми концентрациями ионов в правиле Шульце-Гарди Коагуляция играет важнейшую роль в технологии очистки природной воды от коллоидных примесей на станциях подготовки питьевой воды – эта стадия называется обесцвечиванием и осветлением природной воды. Коллоидными примесями природной воды озер, рек являются кварцевые и глинистые (~60 % SiO2; ~30% Al2O3; ~ 5–10 % FeO и Fe2O3 и др.) частицы, гумусовые вещества – это ВМС органической природы, являющиеся продуктами деструкции остатков растительного и животного происхождения (слабые гуминовые кислоты и фульвокислоты), а также разного рода микроорганизмы. Их поверхность, как правило, имеет отрицательный электрический заряд. Процесс осветления воды протекает при добавлении в нее рассчитанных доз рабочего раствора коагулянта Al2(SO4)3, при этом происходит гидролиз по иону Al3+ с образованием положительно заряженного золя гидроксида алюминия за счет так называемого щелочного резерва природной воды (рН = 5 – 8,5), который обеспечивают находящиеся в ней гидрокарбонат-ионы НСО3 –: Al3+(коагулянт) + 3 НСО3 –(природная вода) → Al(OH)3↓(золь) + 3 СО2↑. Таким образом, возникает сложная дисперсная система, где частицы одной дисперсной фазы заряжены отрицательно (примеси), а другой – положительно (Al(OH)3↓(золь)) – они легко коагулируют, образуя крупные хлопья (рисунок 5), которые затем отфильтровывают на песчаных фильтрах.
Рисунок 5 – Структура хлопьев при малой (а) и большой (б) концентрации коллоидных примесей в очищаемой воде ( 1 – захваченная вода; 2 – гуминовые вещества; 3 – глинистые частицы; 4 – коллоидные частицы гидроксида алюминия)
В природе коагуляционные процессы лежат в основе почвообразования. Интересным примером здесь является происхождение плодородных иловых почв в дельтах некоторых рек, например Нила, Евфрата и Тигра, Волги, Дона, Днепра и др. Коагуляция коллоидных примесей, содержащихся во взвешенном состоянии в речной воде, наступает лишь в устье, где речная вода встречается с соленой морской водой, а остановка течения способствует седиментации коагулированных агрегатов с образованием плодородной дельты.
Поиск по сайту: |


 :
: 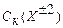 :
: 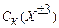 =500:10:1 и позволяет оценить порог коагуляции для данного типа иона, если из опыта известен порог коагуляции для другого типа иона того же знака.
=500:10:1 и позволяет оценить порог коагуляции для данного типа иона, если из опыта известен порог коагуляции для другого типа иона того же знака.