 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Механизм проводимости растворов электролитов. Законы Фарадея для электролиза. Число Фарадея
Механизм проводимости.
Законы Фарадея для электролиза. Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита. Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — ионы кислотных остатков и гидроксильной группы — движутся к аноду. Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Электролиз находит применение для очистки сточных вод. Первый закон Фарадея В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит:
Подставляя (2)-(5) в (1), получим
Второй закон Фарадея Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты. Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где F — постоянная Фарадея. Число Фарадея. Постоя́нная Фараде́я , — физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества. Постоянная Фарадея равна Численно постоянная Фарадея равна электрическому заряду, при прохождении которого через электролит на электроде выделяется (1/z) моль вещества A в формуле: Для постоянной Фарадея справедливо следующее соотношение:
где Вопрос №21.
Поиск по сайту: |



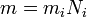 (1)
(1) (2)
(2)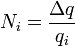 (3)
(3)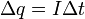 (4)
(4) , где z - валентность атома вещества, e - заряд электрона (5)
, где z - валентность атома вещества, e - заряд электрона (5)



 Кл·моль−1.
Кл·моль−1.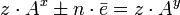

 — количество электронов, участвующих в ходе реакции.
— количество электронов, участвующих в ходе реакции. ,
, — элементарный заряд, а
— элементарный заряд, а  — число Авогадро.
— число Авогадро.