 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу
Зміна концентрацій дорівнює різниці між концентрацією С2, що відповідає моменту часу τ2, і початковою концентрацією С1 в момент часу τ1. Тоді середня швидкість реакції дорівнює:
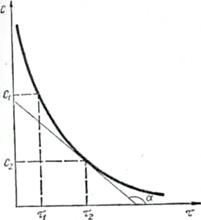
Чим менший проміжок часу ∆τ, тим менша зміна концентрації ∆С і тим ближче відношення ∆С/∆τ до істинної швидкості хімічної реакції. Відомо, що концентрації речовин у хімічному процесі змінюються безперервно (рис. 1), тому правильніше описувати хімічний процес у певний момент часу за допомогою істинної швидкості реакції. Точний математичний вираз істинної швидкості реакції є перша похідна від концентрації за часом:
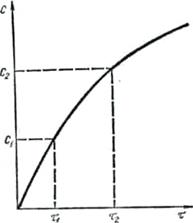
Оскільки швидкість хімічних реакцій завжди додатна і характеризується зміною концентрацій реагуючих речовин (С2 < С1), то величина ∆С (dC) буде від'ємна і відношення ∆С/∆τ (dC/dτ) у формулах (1), (2) треба брати із знаком «мінус». Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакцій (див. рис. 1), то величина ∆С (dC)додатна і відношення ∆С/∆τ (dC/dτ) у формулах (1), (2) треба брати із знаком «плюс». Швидкість хімічних реакцій,
а б Рис. 1. Зміна концентрацій С реагуючих речовин (а) та продуктів реакції (б). як правило, вимірюють у моль/(дм3∙с). Істинна швидкість реакцій дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу (див. рис. 1): Значення швидкості, розраховані за зміною концентрацій вихідних речовин або продуктів реакції, можуть бути різними, якщо всі коефіцієнти в рівнянні реакції не дорівнюють одиниці. Так. швидкість реакції Н2+І2=2НI, виміряна за зміною концентрації НІ, вдвоє більша за швидкість, виміряну за зміною концентрації водню або йоду. Справді, концентрація НІ більша за концентрацію водню в два рази, тому
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів. Закон діючих мас Необхідною умовою перебігу хімічної реакції між двома речовинами є зіткнення їхніх молекул. Зрозуміло, що швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об'єму. Вірогідність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин. Отже. швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції. Ця закономірність має назву закону діючих мас, відкритого російським ученим М.М.Бекетовим і норвезькими вченими К. Гульдбергом і П. Вааге. Для взаємодії двох молекул, наприклад водню і йоду за рівнянням Н2+I2=2НI, в елементарному акті якої беруть участь по одній молекулі, закон діючих мас у матемаїичній формі має вираз:
Для реакції 2NO + Сl2 = 2NOCl швидкість дорівнює:
Для загальної реакції аА + bB = dD +eE швидкість дорівнює:
Величина k у рівнянні (3) є коефіцієнтом пропорційності між швидкістю і концентрацією і називається константою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості при сталій температурі є величина стала і характеризує природу реагуючих речовин. Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степенів у законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер. Розглянемо приклад. Фотохімічне розкладання газоподібного НВг відбувається за стехіометричним рівнянням 2НВг(г) = Н2(г) + Вг2(г). Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул НВг. Насправді зазначена фотохімічна реакція відбувається за таким механізмом: НВг + hv = Н + Вг; Н + НВг = Н2 + Вг; Вг + Вг = Вг2. Отже, ніякого зв'язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, взагалі немає. Збіг, який спостерігається для деяких реакцій, має випадковий характер. Перебіг більшості хімічних реакцій такий, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних або паралельних), які можна вважати елементарними реакціями. Зрозуміло, що швидкість реакції, яка складається з кількох елементарних стадій, зумовлюється швидкістю перебігу повільнішої з них. Сума показників степенів у рівнянні швидкості хімічної реакції (кінетичне рівняння) (3) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Якщо порядок реакції нульовий (швидкість не залежить від концентрації реагуючих речовин), то Швидкість реакції першого порядку описують кінетичним рівнянням
Прикладом реакцій першого порядку є розкладання оксиду азоту(V): N205 = 2NO2 + 1/2O2 Для реакцій другого порядку кінетичне рівняння має вигляд
Прикладом реакцій другого порядку є взаємодія водню і йоду за рівнянням Н2+ I2 = 2НI Для характеристики механізму реакцій застосовують також поняття молекулярності реакції. Під молекулярністю реакції розуміють кількість молекул, які беруть участь в елементарному акті взаємодії. Реакція, для перебігу якої потрібна лише одна молекула, називається мономолекулярною реакцією. Це — реакція розкладанняабо перегрупування, наприклад: I2 = 2I, НВг = Н + Вг; N205 = 2NO2 + 1/2O2 Бімолекулярна реакція потребує для елементарного акту двох частинок (молекул, іонів, атомів): Н2+ I2 = 2НI У тримолекулярних реакціях беруть участь одночасно три молекули (ці реакції відбуваються дуже рідко): 2NO + О2 = 2NO2. Реакцій, молекулярність яких більше ніж три, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул маловірогідне. Фактично всі елементарні хімічні реакції, крім сумарних, є мономолекулярними або бімолекулярними, тобто всі реальні хімічні реакції дуже прості, незважаючи іноді на складність сумарних стехіометричних рівнянь. Отже, сумарна форма рівняння хімічної реакції не виражає складності і багатостадійності процесу, який може складатися з кількох елементарних реакцій різного порядку. Енергія активації Як зазначалось, умовою елементарного акту взаємодії є зіткнення частинок реагуючих речовин. Проте не кожне зіткнення може спричинити хімічну взаємодію. Справді, хімічна взаємодія передбачає перерозподіл електронної густини, утворення нових хімічних зв'язків і перегрупування атомів. Отже, крім зіткнення, для взаємодії частинок необхідно, щоб їх енергія була більшою за енергію відштовхування (енергетичний бар'єр) між їхніми електронними оболонками. Частина молекул у системі внаслідок перерозподілу енергії завжди має певний надмір енергії порівняно з середньою енергією молекул. Тому вони можуть подолати енергетичний бар'єр і вступити в хімічну взаємодію. Такі реакційнодатні молекули дістали назву активних молекул. Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції. Вона потрібна для подолання енергетичного бap'єру. Наявність енергетичного бар'єру призводить до того, що багато які реакції, перебіг яких цілком можливий, самовільно не починаються. Наприклад, вугілля, дерево, нафта, які здатні окислюватись і горіти на повітрі, за звичайних умов не займаються. Це пов’язано з великою енергією активації відповідних реакцій окислення. Підвищення температури збільшує кількість активних молекул і тому дедалі більша кількість молекул кисню, вугілля, дерева і нафти має необхідний запас енергії для початку реакції. При певній температурі швидкість реакції досягає певної величини і починається реакція горіння.Отже, під час хімічного процесу перехід системи вихідних речовин з енергетичним станом Евих у енергетичний стан продуктів реакції Епр здійснюється через енергетичний бар'єр, який дорівнює енергії активації системи ΔЕакт. При цьому тепловий ефект реакції дорівнює ∆H = Eпр - Евих На рис. 2 наведено енергетичну схему взаємодії водню і йоду. Характерною особливістю цієї реакції є те, що під час взаємодії активних молекул водню і йоду спочатку утворюється проміжна сполука Н2 • • • І2, яка називається активним комплек-сом. Саме в цьому комплексі відбувається розрив зв'язків Н—Н і І—І і утворення нових зв'язків Н—І.
Як видно з рис.2, енергія активації реакції ∆Еакт менша за енергію дисоціації ∆Едис вихідних молекул на вільні атоми. Таким чином, перебіг реакції через проміжний активний комплекс енергетично вигідніший, ніж перебіг реакції через повний розрив зв'язків вихідних молекул і утворення вільних атомів. Більшість хімічних реакцій відбувається через стадію утворення проміжних активних комплексів, Рис.2. Енергетична схема взаємодії водню і йоду а енергія їх утворення є енергією активації реакції. Енергія активації ∆Еакт — важлива характеристика хімічних перетворень. Саме енергія активації затримує або робить неможливими багато які реакції, які з погляду термодинаміки можуть відбуватися самовільно. Якби енергія активації для всіх реакцій дорівнювала нулю (∆Еакт = 0), то в природі відбувалося б безліч хаотичних хімічних реакцій, для яких величина ∆G від'ємна. Так, вугілля і нафта при контакті з повітрям загорілися б, азот повітря і вода утворили б розчин азотної кислоти, живі клітини зруйнувалися б внаслідок гідролізу. Отже, існування багатьох молекул, кристалічних речовин і навіть живих клітин можливе лише тому, що їхні перетворення і руйнування пов'язані з подоланням значного енергетичного бар'єру.
Поиск по сайту: |
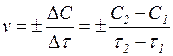 (1)
(1)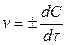 (2)
(2)
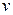 = tg α.
= tg α.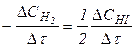


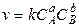 (3)
(3)