 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Построение рабочей линии, кривой равновесия и теоретических тарелокСтр 1 из 8Следующая ⇒
Национальный технический университет «Харьковский политехнический институт»
Кафедра химической техники и промышленной экологии
Методические указания к выполнению расчетной работы «Расчет абсорбционной установки»
по дисциплине: «Оборудование и основы проектирования экологически безопасных технологий с использованием САПР»
Харьков 2012 содержание 1. АБСОРБЦИЯ.. 3 1.1. Основные условные обозначения: 3 1.2. Общие сведения. 5 1.3. Методика расчета. 6 1.3.1. Материальный баланс. 6 1.3.2. Тепловой баланс. 8 1.3.3. Построение рабочей линии, кривой равновесия и теоретических тарелок 9 1.3.4. Определение движущей силы процесса абсорбции. 10 1.3.5. Расчет скорости и диаметра абсорбера. 11 1.3.6. Расчет поверхности массопередачи и высоты абсорбера. 17 1.4. Гидравлическое сопротивление абсорберов. 27 1.4.1. Гидравлическое сопротивление насадочных колонн. 27 1.4.2. Гидравлическое сопротивление тарельчатых колонн. 29 1.5. Пример расчета насадочного абсорбера. 32 1.5.1. Задание на проектирование. 34 1.5.2. Материальный баланс. 34 1.5.3. Определение скорости газа и диаметра абсорбера. 36 1.5.4. Определение высоты насадочной колонны. 38 1.5.5. Расчет гидравлического сопротивления насадки. 42 1.6. Варианты заданий для расчета абсорбционной установки. 45 Литература. 46
АБСОРБЦИЯ 1.1. Основные условные обозначения: G – расход газа, кг/с; L – расход поглотителя, кг/с;
x, X– концентрация поглощаемого компонента в жидкости соответственно в мольных долях и относительных мольных концентрациях;
y, Y– концентрация извлекаемого компонента в газовой фазе соответственно в мольных долях и относительных мольных концентрациях; ε – степень извлечения компонента из газовой фазы; Е– коэффициент Генри; Н0 – коэффициент распределения; Р, р – давление, Па; f– удельная поверхность насадки, м2/м3; D – коэффициент диффузии, м2/с; D, d – диаметр, м; F – площадь поверхности массопередачи, м2; S – площадь сечения колонны, м2; g – ускорение свободного падения, м/с2; H, h – высота, м; K – коэффициент массопередачи, кг/(м2·с·ед.дв.силы); M – Массовый расход вещества, кг/с; мольная масса, кг/кмоль; T, t – температура, ºC; U – плотность орошения, м3/(м2·с); ω – скорость газа, м/с; β – коэффициент массоотдачи; Vс– свободный объем, м3/м3; ρ – плотность, кг/м3; μ– динамический коэффициент вязкости, Па·с; σ– поверхностное натяжение, Н/м; λ – коэффициент трения; ξ– коэффициент местного сопротивления; ψ – коэффициент смачиваемости; l– удельный расход поглотителя, кг/кг; Re – критерий Рейнольдса; Nu – диффузионный критерий Нуссельта; Pr– диффузионный критерий Прандтля; Ar – критерий Архимеда. Индексы: н – начальный параметр; к– конечный параметр; ж, х – жидкая фаза; г, у – газовая фаза; ср– среднее значение; и.г. – инертный газ; k– поглощаемый компонент; * – равновесный состав. Общие сведения Абсорбцией называется процесс избирательного поглощения компонентов из газовой или паровой смеси жидким поглотителем (абсорбентом), в котором данный компонент растворим. Различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа (пара) не сопровождается изменением его химической природы. Абсорбция протекает до тех пор, пока парциальное давление поглощаемого компонента в газовой (паровой) фазе остается выше равновесного давления над раствором. При хемосорбции (абсорбции, сопровождаемой химической реакцией) поглощаемый компонент вступает в химическую реакцию с поглотителем и образует химическое соединение. Абсорбируемые компоненты газовой смеси условимся называть абсорбтивом, а неабсорбируемые – инертом. Протекание абсорбционных процессов характеризуется статикой и кинетикой. Статика абсорбции, т.е. равновесие между жидкой и газовой фазами, определяет состояние, которое устанавливается при весьма продолжительном соприкосновении фаз. Кинетика (скорость) абсорбции определяется движущей силой процесса, т.е. степенью отклонения системы от состояния равновесия, свойствами поглотителя, компонента и инертного газа, а также способом соприкосновения фаз. Для проведения процесса абсорбции применяют абсорбционные установки, основным элементом которых являются абсорбционные аппараты. Абсорбционные аппараты классифицируются по технологическому назначению, давлению и виду внутреннего устройства, обеспечивающего контакт газа (пара) и жидкости. По технологическому назначению абсорбционные аппараты подразделяются на аппараты установок осушки, очистки газа, газораспределения и т. д. В зависимости от внутреннего устройства различают тарельчатые, насадочные, распылительные, роторные (механические), поверхностные и каскадные абсорберы. Наиболее широко распространены тарельчатые и насадочные аппараты. В зависимости от применяемого давления аппараты подразделяются на вакуумные, атмосферные и работающие под давлением выше атмосферного. При выборе типа аппарата следует учитывать технологические требования к процессу и его экономические показатели. Плёночные аппараты (к которым относятся также абсорберы с регулярной насадкой) незаменимы при проведении процесса в условиях разрежения, поскольку их гидравлическое сопротивление самое низкое. Пленочные и насадочные колонны предпочтительнее также для обработки коррозионных сред и пенящихся жидкостей. Тарельчатые колонны удобны для крупнотоннажных производств, при относительно малых расходах жидкости, недостаточных для равномерного смачивания насадки, а также для процессов, сопровождающихся колебаниями температуры, так как периодическое расширение и сжатие корпуса может разрушить хрупкую насадку. На тарелках проще установить змеевики для подвода и отвода теплоты. Тарельчатые колонны применяются также при обработке потоков с твердыми примесями или при выделении твердого осадка.
Методика расчета Целью расчета абсорберов является определение расхода поглотителя, температуры процесса и количества отводимой теплоты, выбор скорости газа, насадки (для насадочных колонн) и типа тарелок (для тарельчатых колонн), размеров и гидравлического сопротивления аппаратов. Схема расчета насадочных и тарельчатых аппаратов для проведения процесса физической абсорбции, не осложненной промежуточным отбором или рециркуляцией жидкости, показана на рис. 1.1.
Материальный баланс Состав фаз. Концентрация поглощаемого при абсорбции компонента может быть выражена в различных единицах (мольные или массовые доли, относительные мольные или массовые концентрации и др.). Если объемная доля поглощаемого компонента (абсорбтива) в газовой фазе(у)выражена в процентах, то пересчет этой концентрации в выбранные для расчета единицы выполняется следующим образом. Пересчет объемной доли у в (кмоль абсорбтива)/(кмоль инерта) – Y
или объемной доли – у в (кг абсорбтива)/(кг инерта) –
При заданной начальной концентрации поглощаемого компонента в газовой фазе
Конечную концентрацию поглощаемого компонента
где x* – равновесная концентрация поглощаемого компонента, которая определяется расчётным путём или находится по справочным данным; η – степень насыщения раствора. Концентрация компонента в газовой фазе может быть выражена через его парциальное давление. Мольная (объёмная) доля любого компонента смеси идеальных газов: y = pA /P где pA — парциальное давление поглощаемого компонента А в газовой фазе; Р — общее давление смеси газов или паров. Согласно закону Генри, равновесное парциальное давление р* компонента газовой фазы пропорционально его содержанию в растворе:
Значения коэффициента Генри Е для водных растворов приведены в [1; 2]. Подставив в уравнение значение р* из уравнения , получим:
где H0 – коэффициент распределения, который рассчитывается по формуле:
Выражая y* в относительных мольных концентрациях, получим:
или в относительных массовых концентрациях
Равновесное содержание
Равновесная концентрация X* может быть рассчитана по формуле . Предполагая, что концентрация жидкости на выходе из абсорбера достигнет значения Xк*при взаимодействии с газовой фазой, содержащей Yн,
После определения состава фаз рассчитываем количество вещества, переходящего из газовой фазы в жидкую из уравнения материального баланса:
Общий расход поглотителя:
Удельный расход поглотителя:
Тепловой баланс При растворении газа в жидкости выделяется большое количество теплоты. При отсутствии отвода теплоты температура повышается, что ведет к возрастанию равновесного парциального давления компонента, изменению положения линии равновесия, уменьшению движущей силы процесса, ухудшению условий абсорбции. Практически процесс абсорбции проводится с интенсивным отводом теплоты, чтобы температура раствора в аппарате повышалась незначительно. Количество теплоты Q (кВт), выделяющейся при абсорбции, равно:
где Ф – дифференциальная теплота растворения, Дж/кг. Если абсорбция ведется без отвода теплоты, можно считать, что вся выделяемая теплота идет на нагревание жидкости:
где с – удельная теплоемкость жидкости, Дж/(кг·К); t1, t2 – температура жидкости на входе в абсорбер и на выходе из него, ºC. Приравняв правые части уравнений и , получим уравнение теплового баланса абсорбера, работающего без отвода теплоты:
Из этого уравнения находим температуру жидкости на выходе из абсорбера:
где Ф – дифференциальная теплота растворения, Дж/кг; с – удельная теплоемкость жидкости, Дж/(кг·К). Дифференциальные теплоты растворения некоторых газов в воде при 20 ºC приведены в табл. 1.1. Таблица 1.1 Дифференциальные теплоты растворения некоторых газов в воде
Примечание. Дифференциальные теплоты растворения некоторых газов в различных поглотителях приведены в [2]. Построение рабочей линии, кривой равновесия и теоретических тарелок Для определения числа теоретических тарелок[1] необходимо в системе координат По начальным и конечным концентрациям поглощаемого газа и поглотителя строим рабочую лриию, т. е. прямую АВ, которая проходит через точки Построение линии равновесия выполняется следующим образом. Задаваясь рядом значений Дальнейшие расчеты для построения линии равновесия могут выполняться одним из следующих методов. 1. Выполняем пересчет концентраций в мольные доли; по формулам , определяются значения равновесного парциального давления р* и равновесное содержание
2. По формуле определяем величину коэффициента распределения H0 и, далее, по формуле (8.10) – значение В приведенных методах построения кривой равновесия концентрации компонента в газовой и жидкой фазах выражаются в относительных массовых концентрациях. Построение можно также выполнить, выражая концентрации в относительных мольных единицах.
Парциальное давление поглощаемого компонента при различных концентрациях можно найти по справочным данным. Определение числа теоретических тарелок графическим методом путем построения ступенчатой линии между точками А и В показано на рис. 1.3. Число точек пересечения с линией равновесия дает число теоретических тарелок (на рис. 1.3 – 2 тарелки).
Поиск по сайту: |
 – концентрация поглощаемого компонента в жидкости соответственно в массовых долях и относительных массовых концентрациях;
– концентрация поглощаемого компонента в жидкости соответственно в массовых долях и относительных массовых концентрациях; – концентрация извлекаемого компонента в газовой фазе соответственно в массовых долях и относительных массовых концентрациях;
– концентрация извлекаемого компонента в газовой фазе соответственно в массовых долях и относительных массовых концентрациях;


 .
. и степени извлечения ε конечная концентрация поглощаемого компонента в газовой фазе
и степени извлечения ε конечная концентрация поглощаемого компонента в газовой фазе  определяется как:
определяется как: .
. в жидкости, выходящей из колонны при известной степени насыщения η раствора, находят по формуле:
в жидкости, выходящей из колонны при известной степени насыщения η раствора, находят по формуле: ,
, .
. ,
, .
.
 .
. поглощаемого компонента в газовой фазе определяется как:
поглощаемого компонента в газовой фазе определяется как: .
. .
. .
. .
. .
. ,
, ,
, .
. ,
, построить рабочую линию и линию равновесия.
построить рабочую линию и линию равновесия.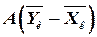 и
и  (рис. 1.2). Она расположена выше линии равновесия, так как при абсорбции содержание компонента в газовой фазе выше равновесного.
(рис. 1.2). Она расположена выше линии равновесия, так как при абсорбции содержание компонента в газовой фазе выше равновесного.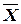 , находим по формуле соответствующие им температуры t2. По найденным температурам определяем по справочным данным [1] или по эмпирическим формулам [2] соответствующие им коэффициенты Генри.
, находим по формуле соответствующие им температуры t2. По найденным температурам определяем по справочным данным [1] или по эмпирическим формулам [2] соответствующие им коэффициенты Генри.
