 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Диссоциация кислот, оснований и солей
С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода, а к основаниям вещества, которые при диссоциации дают гидроксид-ионы. Наличие в молекулах кислот ионов водорода определяет важнейшие общие свойства этого класса соединений: 1. Способность взаимодействовать с основаниями с образованием солей. 2. Способность выделять водород при взаимодействии с активными металлами (Zn, Fe, Mg, AI и др.). 3. Изменение окраски индикаторов. 4. Кислый вкус. Сильные кислоты полностью диссоциированы на ионы:
НNO3 → Н+ + NО3-. Слабые кислоты диссоциируют частично:
СН3СООH ↔ H+ + CH3COO-,
Слабые многоосновные кислоты диссоциируют ступенчато:
Н2СО3 ↔ Н+ + НСО3- НСО3- ↔ Н+ + СО32- Наличие в молекулах оснований гидроксид-ионов обусловливают следующие общие свойства этих соединений: 1. способность взаимодействовать с кислотами с образованием солей; 2. водные растворы оснований изменяют окраску индикаторов; 3. растворы оснований имеют горький вкус и скользкие на ощупь. Щелочи диссоциируют в водных растворах полностью:
NaOH → Na+ + ОН-. Слабые основания диссоциируют частично:
NH4OH ↔ NH4+ + ОН-,
Слабые многокислотные основания диссоциируют ступенчато:
Mg(ОН)2 ↔ MgОН+ + ОН- MgОН+ ↔ Mg2++ OH- В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортоборной кислоты протекает в три ступени: 1. H3BO3 ↔ H+ + H2BO-3; 2. H2BO3- ↔ H+ + HBO2-3; 3. HBO32- ↔ H+ +BO3-3; Поскольку Кдисс1 >Кдисс2 > Кдисс3 , то в наибольшей степени диссоциация протекает по первой ступени a1 > a2 > a3. Суммарный процесс диссоциации H3BO3
H3BO3 ↔ 3H+ + BO3-3 характеризуется полной константой диссоциации:
Перемножив правые и левые части равенств (1) – (3), получим:
откуда видно, что полная константа диссоциации численно равна произведению ступенчатых констант:
Амфотерные гидроксиды проявляют кислотно-основную двойственность. При взаимодействии с кислотой амфотерный гидроксид является донором гидроксогрупп: Cr(OH)3 + 3HCl ↔ CrCl3 + 3H2O Cr(OH)3 + 3H+ ↔ Cr3+ + 3H2O, а при взаимодействии с основанием - их акцептором:
Cr(OH)3 + 3КОН ↔ К3[Сr(ОН)6], Cr(OH)3 + 3ОН- ↔ [Сr(ОН6)]3-. Соли диссоциируют с образованием катионов металла и анионов кислотного остатка:
NaNO3 → Na+ + NO3-. При диссоциации кислых солей образуются катионы металла и гидроанионы, которые частично диссоциируют с образованием ионов водорода:
NaHCO3 → Na+ +HCO3-; HCO3- ↔ H+ + CO32-. Молекулы основных солей диссоциируют в растворе на гидроксокатионы и анионы кислотного остатка:
FeOHSO4 → FeOH2+ + SO42-. Гидроксокатионы частично диссоциируют с образованием катионов металла и гидроксид-ионов:
FeOH2+ ↔ Fe3+ + OH-.
Поиск по сайту: |
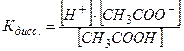 .
.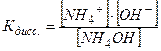 .
. (1)
(1)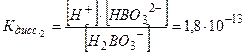 (2)
(2)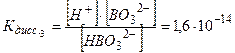 (3)
(3)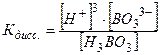 .
.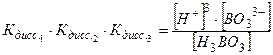 ,
,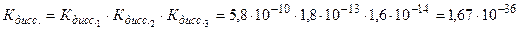 .
.