 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кинетика общего кислотно-основного катализа ⇐ ПредыдущаяСтр 3 из 3
Диссоциацию кислоты
Так как в общем кислотном катализе каталитическим действием обладают также недиссоциированные молекулы кислоты и молекулы растворителя, то скорость лимитирующей стадии может состоять из трех слагаемых:
Для общего основного катализа получаем
где Общий кислотно- основной катализ имеет место в том случае, когда переход протона является замедленной стадией и сам катализатор (кислота или основание) участвует в лимитирующей стадии. Кинетику общего кислотно-основного катализа рассмотрим на примере общего кислотного катализа. Рассмотрим двустадийную реакцию:
где Р – продукт реакции. Если вторая стадия является лимитирующей, то скорость реакции равна:
Первая стадия реакции практически равновесна, поэтому концентрации реагентов, участвующих в этой стадии можно определить, зная константу равновесия: Отсюда С учетом этих выражений скорость и константа скорости общего кислотного катализа равны:
В данном случае в выражение для эффективной константы скорости реакции общего кислотного катализа входит только одно слагаемое. Из полученных уравнений следует, что в общем кислотном катализе на скорость реакции влияет не только рН раствора, но и природа кислоты катализатора. Величину
Если провести серию опытов при разной концентрации кислоты-катализатора (НА ) при постоянной рН раствора (используется буферный раствор), то величина L будет постоянной. На графике в координатах Для разных кислот-катализаторов угловой коэффициент и, следовательно, величина Для общего кислотно-основного катализа между константой скорости каталитической реакции
или в логарифмической форме
Эти соотношения хорошо подтверждаются опытом. Например, если для данной гомогенной каталитической реакции использовать разные однотипные кислоты-катализаторы, то на графике в координатах Гетерогенный катализ
При гетерогенном катализе катализатор представляет собой твердое тело, а реагирующие вещества могут находиться в газовой или жидкой фазе. Механизм гетерогенного катализа в принципе не отличается от гомогенного. Также как и в гомогенном катализе, реагенты образуют активированные комплексы или неустойчивые промежуточные соединения. Только при гетерогенном катализе активированные комплексы или промежуточные соединения образуются на поверхности катализатора. Механизм гетерогенного катализа сложнее, чем механизм гомогенного катализа, так как протеканию каталитической реакции предшествует адсорбция реагентов на поверхности твердого катализатора. Гетерогенные катализаторы обладают некоторыми особенностями. Прибавление к катализатору вещества, которое само не является катализатором, может в некоторых случаях значительно повысить активность катализатора. Такие вещества называют промоторами или модификаторами. Промоторы влияют на состояние поверхности катализатора – они способствуют сохранению активных центров на поверхности и изменяют распределение активных центров по энергиям адсорбции. Срок службы катализаторов зависит от многих факторов, основными из которых являются: отравление и старение. Присутствие в реагирующей смеси некоторых веществ, часто в ничтожных количествах, способно понижать или полностью подавлять каталитическую активность катализатора. Такие вещества называют каталитическими ядами, а само явление - отравлением катализатора. К типичным каталитическим ядам относятся: соединения серы, ртуть и соли ртути, соединения фосфора, мышьяка, свинца и другие. Так, например, платиновый катализатор, применяемый при производстве серной кислоты, очень чувствителен к наличию в реакционных газах самых незначительных количеств мышьяковистых соединений, снижающих каталитическую активность. Каталитические яды снижают срок службы катализаторов. Снижение активности катализатора может вызываться старением катализатора. Например, при использовании тонкораздробленного катализатора снижение активности может происходить в результате процесса рекристаллизации, при котором мелкодисперсная структура превращается в крупнокристаллическую, имеющую меньшую поверхность. Наиболее часто в гетерогенном катализе используются металлы, сплавы металлов, оксиды и смеси оксидов (шпинели). В гетерогенных реакциях, протекающих на поверхности твердого катализатора, можно выделить пять основных стадий (могут быть и другие стадии): 1) диффузия вещества к поверхности катализатора; 2) обратимая адсорбция вещества; 3) реакция на поверхности в адсорбционном слое; 4) обратимая десорбция продуктов с поверхности; 5) диффузия продуктов реакции от поверхности в объем. Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий. Если диффузия происходит достаточно быстро и равновесие адсорбция Простейший механизм гетерогенного катализа описывается схемой:
На энергетическом профиле реакции, протекающей на поверхности катализатора, появляются дополнительные максимумы и минимумы (рис. ), связанные с процессами адсорбции реагентов (1
Рис. Изменение энергетического профиля реакции при гетерогенном катализе. Сплошная кривая соответствует реакции без катализатора, пунктирная – каталитической реакции. 1 – реагенты, 2 – гомогенный активированный комплекс, 3 – адсорбированный активированный комплекс, 4 – адсорбированные реагенты, 5 – адсорбированные продукты, 6 – продукты в объеме. Одной из важных стадий каталитического процесса является адсорбция реагирующих молекул на поверхности катализатора. Для описания кинетики гетерогенно-каталитических реакций необходимо знать уравнение, описывающее адсорбцию веществ на поверхности. Адсорбцией называется поглощение вещества на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из фазы называется адсорбатом. Различают два вида адсорбции: физическую адсорбцию и хемосорбцию. При физической адсорбции, адсорбированные молекулы связаны с молекулами поверхности твердого тела Ван-дер-ваальсовыми силами (дисперсионными, индукционными и ориентационными). Физическая адсорбция – это обратимый процесс. Хемосорбция определяется химическими, валентными силами, возникающими между адсорбированными молекулами и атомами поверхности катализатора. Химическая адсорбция необратима. Адсорбция сопровождается выделением тепла, причем при хемосорбции тепловой эффект значительно больше, чем при физической адсорбции и может составлять сотни кДж/моль. Способностью к хемосорбции обладают молекулы с высоким запасом энергии. Хемосорбированные молекулы на поверхности твердого тела представляют собой поверхностные химические соединения, которые по своим свойствам сильно отличаются от аналогичных объемных соединений. Зависимость равновесного количества адсорбата на поверхности от давления или от концентрации вещества в растворе при постоянной температуре называется изотермой адсорбции. Наиболее простой изотермой адсорбции является изотерма адсорбции Лэнгмюра (модель идеального адсорбционного слоя). При выводе изотермы адсорбции Лэнгмюра принимается ряд предположений, упрощающих описание процесса адсорбции: 1. все места на поверхности твердого тела (активные центры), на которых происходит адсорбция, энергетически равноценны; 2. между адсорбированными частицами отсутствует взаимодействие; 3. на одно место (на один активный центр поверхности) приходится одна частица (при адсорбции не происходит ни диссоциации, ни ассоциации адсорбированных частиц). Скорость адсорбции вещества пропорциональна поверхности катализатора (адсорбента) не занятой адсорбированными частицами (адсорбатом) и парциальному давлению вещества в объеме газа:
где
Скорость десорбции адсорбата пропорциональна доле поверхности катализатора, занятой адсорбатом:
где При адсорбционном равновесии скорость адсорбции равна скорости десорбции:
Обозначая
где Это выражение называется уравнением изотермы адсорбции Лэнгмюра. Если на поверхности твердого тела адсорбируется смесь газов, то степень заполнения поверхности катализатора
где сумма берется по всем компонентам газовой смеси. Рассмотрим такой процесс, когда скорость гетерогенно-каталитической реакции лимитируется скоростью химической реакции, протекающей в адсорбционном слое на однородной поверхности катализатора (модель идеального адсорбционного слоя). В общем случае уравнение химической реакции на поверхности можно записать следующим образом:
Согласно закону действующих масс для гетерогенной реакции, скорость реакции пропорциональна произведению поверхностных концентраций исходных веществ, в степенях, равных стехиометрическим коэффициентам, с которыми они входят в уравнение реакции. Поверхностную концентрацию заменяют пропорциональной ей величиной – степенью заполнения поверхности данным реагентом. Тогда скорость гетерогенно-каталитической реакции можно выразить уравнением:
где Степень заполнения Таким образом, согласно (6.41), скорость гетерогенно-каталитической реакции определяется давлением не только исходных веществ, но и продуктов реакции. Для описания кинетики гетерогенно-каталитических реакций используют и другие уравнения адсорбции, например, уравнение Фрейндлиха, уравнение полимолекулярной адсорбции БЭТ (Брунауэр, Эммет и Теллер) и другие. Применим полученные уравнения к простейшему случаю –мономолекулярной гетерогенной каталитической реакции, протекающей в газовой фазе: А ® В В этой реакции скорость реакции пропорциональна степени заполнения поверхности молекулами реагента: Пусть степень заполнения определяется по уравнению Лэнгмюра:
где bА и bВ – адсорбционные коэффициенты исходного вещества А и продукта В. Тогда скорость процесса будет равна:
где Рассмотрим предельные случаи полученного кинетического уравнения. Если адсорбционная способность продукта и реагента мала, Эффективная константа скорости реакции
Экспериментальная энергия активации складывается из энергии активации гетерогенной реакции и энтальпии адсорбции Если адсорбционная способность продукта мала, а исходного вещества велика и реакция будет иметь нулевой порядок. Такой режим соответствует максимальной загрузке катализатора. Рассмотрим порядок решения кинетических задач для гетерогенно-каталитических процессов. Пусть на поверхности твердого катализатора протекает химическая реакция первого порядка. Все участники реакции - газы. В ® gG + rR. Реакция осуществляется в реакторе закрытого типа (V = const.). Случай 1. На поверхности катализатора наблюдается слабая адсорбция только вещества В. Для решения кинетической задачи запишем: а) скорость реакции в дифференциальной форме
б) скорость реакции на основе закона действующих поверхностей
Если
Тогда:
Так как реакция протекает в газовой фазе, продукты реакции не адсорбируются, поэтому степень заполнения поверхности катализатора реагентом можно выразить через уравнение Лэнгмюра:
Объединяя (50) и (51) получим:
Так как адсорбция вещества В- слабая, то b∙рB <<1, поэтому:
В уравнении (53) три переменные величины - t, x и рB. Так как вся реакция протекает в газовой фазе, то число молей компонента В связано с парциальным давлением этого компонента уравнением Менделеева- Клапейрона:
где V - объем реактора. Из уравнения (54) можно найти производную
Уравнение (55) подставим в уравнение (53), разделим переменные и проинтегрируем полученное уравнение:
В результате интегрирования получим:
Из этого уравнения можно вычислить константу скорости гетерогенной каталитической химической реакции первого порядка в случае слабой адсорбции исходного вещества:
Если параметры реактора остаются постоянными, то уравнение принимает вид обычного уравнения для реакции первого порядка с константой скорости каталитического процесса равной:
[1] Уравнение (6) можно использовать для сравнения каталитической активности двух катализаторов только, если для обоих катализаторов механизм каталитического действия одинаков.
Поиск по сайту: |
 и основания В можно представить в виде следующих протолитических реакций с участием растворителя (
и основания В можно представить в виде следующих протолитических реакций с участием растворителя (  ):
): .
. ,
, 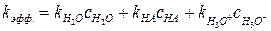 . (6.29)
. (6.29) , (6.30)
, (6.30) - концентрация исходного вещества.
- концентрация исходного вещества.
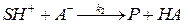 ,
, . (6.31)
. (6.31) .
. .
. , (6.32)
, (6.32) , (6.33)
, (6.33) .
. можно определить из экспериментальных данных. Запишем уравнение (6.29) для
можно определить из экспериментальных данных. Запишем уравнение (6.29) для  следующим образом:
следующим образом: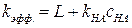 ;
; 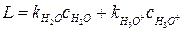 . (6.34)
. (6.34)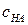 получим прямую линию с угловым коэффициентом равным
получим прямую линию с угловым коэффициентом равным  и константой ионизации
и константой ионизации  кислоты-катализатора (в случае общего кислотного катализа) или константой основности
кислоты-катализатора (в случае общего кислотного катализа) или константой основности 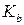 основания катализатора (в случае общего основного катализа) выполняется соотношение линейности (корреляционное соотношение Бренстеда):
основания катализатора (в случае общего основного катализа) выполняется соотношение линейности (корреляционное соотношение Бренстеда): ;
;  , (6.35)
, (6.35) ;
;  . (6.36)
. (6.36)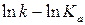 , опытные точки располагаются на прямой линии в соответствии с уравнением (6.36).
, опытные точки располагаются на прямой линии в соответствии с уравнением (6.36). десорбция устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента могут играть свободные адсорбционные центры.
десорбция устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента могут играть свободные адсорбционные центры. .
. 4), десорбции продуктов (5
4), десорбции продуктов (5  меньше истинной энергии активации в адсорбционном слое
меньше истинной энергии активации в адсорбционном слое  на величину теплового эффекта адсорбции реагента:
на величину теплового эффекта адсорбции реагента:  .
. , (6.37)
, (6.37) - доля поверхности адсорбента, занятая частицами адсорбата, или - степень заполнения;
- доля поверхности адсорбента, занятая частицами адсорбата, или - степень заполнения; - константа скорости адсорбции;
- константа скорости адсорбции;  - площадь поверхности катализатора.
- площадь поверхности катализатора.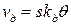 , (6.38)
, (6.38) - константа скорости десорбции.
- константа скорости десорбции. . Отсюда получаем:
. Отсюда получаем: . (6.39)
. (6.39) , получаем выражение для доли поверхности адсорбента, занятой частицами адсорбата:
, получаем выражение для доли поверхности адсорбента, занятой частицами адсорбата: , (6.40)
, (6.40) - константа адсорбционного равновесия или адсорбционный коэффициент.
- константа адсорбционного равновесия или адсорбционный коэффициент. - м газом рассчитывается по уравнению:
- м газом рассчитывается по уравнению: , (6.41)
, (6.41)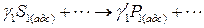 ,
,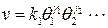 , (6.42)
, (6.42) (6.43)
(6.43) , (6.44)
, (6.44) , (6.45)
, (6.45)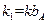 .
. ,
,  , то этими слагаемыми в знаменателе уравнения можно пренебречь и скорость реакции пропорциональна парциальному давлению реагента и реакция имеет первый порядок
, то этими слагаемыми в знаменателе уравнения можно пренебречь и скорость реакции пропорциональна парциальному давлению реагента и реакция имеет первый порядок  .
. ,
,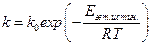 . (6.46)
. (6.46) , то почти вся поверхность катализатора будет заполнена молекулами реагента, скорость реакции будет постоянной:
, то почти вся поверхность катализатора будет заполнена молекулами реагента, скорость реакции будет постоянной:
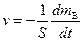 ; (6.47)
; (6.47) . (6.48)
. (6.48)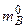 – исходное количество молей вещества В, участвующее в реакции, а (
– исходное количество молей вещества В, участвующее в реакции, а ( 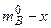 ) – количество молей вещества В к моменту времени t , то:
) – количество молей вещества В к моменту времени t , то: . (49)
. (49)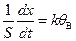 . (50)
. (50)
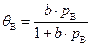 . (51)
. (51) . (52)
. (52) . (53)
. (53) , (54)
, (54)
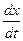 :
: . (55)
. (55) . (56)
. (56)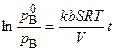 . (57)
. (57) . (58)
. (58) . (59)
. (59)