 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Свойства катализаторовСтр 1 из 3Следующая ⇒
Основные понятия и особенности катализа Катализ имеет огромное значение в природе и технике. Каталитическими являются процессы синтеза белков и обмен веществ в биологических системах, процессы глубокой переработки нефти, синтез и окисление аммиака, производство серной кислоты и метанола и т. д. В настоящее время около 80 % всей химической продукции получается с помощью каталитических процессов. Каталитические реакции были известны в глубокой древности, однако систематически изучать их начали только в начале прошлого (XXI) века. Термин ²катализ² ввёл Берцелиус в 1836 г. Катализ можно определить как возбуждение химических реакций или изменение их скорости под влиянием веществ-катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточного взаимодействия свой химический состав. Современное определение катализа сформулировано в работах Г.К. Борескова. Катализ – это явление возбуждения химической реакции или изменения их скорости под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих свой химический состав после каждого цикла промежуточного взаимодействия. Различные каталитические процессы имеют ряд общих характерных особенностей, связанных в основном с особой ролью катализатора и закономерностями его действия при протекании химических реакций. 1. При каталитических процессах отсутствуют стехиометрические соотношения между количеством катализатора и реагирующими веществами, так как катализатор во время процесса не расходуется и остаётся химически неизменным. Однако свое физическое состояние катализатор может изменять, например, он может спекаться, отравляться и т. д. Важно отметить, что возможные изменения представляют собой побочные явления, не связанные с его каталитическим действием. 2. Катализатор не влияет на константу равновесия химической реакции, так как стандартное изменение энергии Гиббса процесса (DG) без катализатора и в его присутствии одинаково. 3. В присутствии катализатора реакции ускоряются, то есть увеличивается константа скорости реакции. Согласно теории абсолютных скоростей реакций константа скорости реакции равна:
Из формулы следует, что катализатор увеличивает скорость реакции за счет уменьшения энергии активации или увеличения энтропии активации. По фазовому составу компонентов различают гомогенные и гетерогенные каталитические реакции. При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. Гомогенно каталитические реакции в газовой фазе «в чистом виде» встречаются редко и большинство их связано с протеканием цепных реакций. При гетерогенном катализе катализатор находится в другой фазе. К гетерогенным каталитическим реакциям относятся процессы, протекающие на поверхности раздела фаз: газ – твёрдое тело, жидкость – твёрдое тело, жидкость – газ. В качестве катализаторов, как правило, выступают твёрдые тела: металлы, оксиды, соли и др. В гомогенном катализе выделяют еще ферментативный катализ. Ферментативный катализ – реакции, катализируемые биокатализаторами, т.е. ферментами, которые синтезируются живыми организмами и отличаются высокой специфичностью. Этот вид катализатора можно отнести к группе гомогенных каталитических реакций. Иногда их относят к микрогетерогенному катализу, когда катализатор находится в коллоидном состоянии. Свойства катализаторов. 1. Каталитическая активность катализатора. Мерой каталитической активности катализатора (А) является изменение скорости химической реакции в результате введения в систему катализатора:
где vx и v0 – скорость реакции в присутствии катализатора и без него.
Удельной каталитической активностью называют каталитическую активность, отнесенную к концентрации катализатора:
где сk – концентрация катализатора в системе. В гетерогенном катализе удельной каталитической активностью называют каталитическую активность, отнесенную к единице поверхности s твердого катализатора:
Отношение удельных активностей разных катализаторов для данной реакции можно приближенно охарактеризовать отношением констант скоростей реакций:
Для однотипных катализаторов вероятность образования активированного комплекса, следовательно, и энтропии активации с участием катализатора приблизительно одинакова:
В гомогенном ферментативном катализе мерой каталитической активности является число оборотов реакции (turnover number), т.е. количество молекул, превращающихся за единицу времени на одном активном центре:
где Число оборотов принимает различные значения в зависимости от типа катализатора: 10–7 – 10–2 с-1 для катализаторов кислотно–основного характера и 10–2 – 10–5 с-1 – для ферментов, причем у каталазы достигает значения (2,5 –5)106 с-1.
Поиск по сайту: |
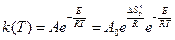 . (6.1)
. (6.1) , (6.2)
, (6.2)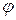 – доля объема системы, занимаемая катализатором и недоступная для реагирующих веществ. Часто второй член
– доля объема системы, занимаемая катализатором и недоступная для реагирующих веществ. Часто второй член 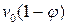 в уравнении настолько мал по сравнению с первым, что им можно пренебречь. Поэтому каталитическая активность – величина, симбатная скорости реакции:
в уравнении настолько мал по сравнению с первым, что им можно пренебречь. Поэтому каталитическая активность – величина, симбатная скорости реакции: (6.3)
(6.3)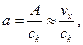 (6.4)
(6.4)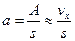 . (6.5)
. (6.5) (6.6)
(6.6)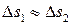 . Поэтому
. Поэтому *[1] (6.7)
*[1] (6.7) (6.8)
(6.8)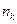 – число оборотов реакции, с-1; v – скорость реакции, моль/л·с;
– число оборотов реакции, с-1; v – скорость реакции, моль/л·с; 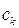 – концентрация катализатора, моль·л-1.
– концентрация катализатора, моль·л-1.