 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теорія мономолекулярної адсорбції Ленгмюра ⇐ ПредыдущаяСтр 3 из 3
В цій теорії адсорбція розглядається як псевдохімічна реакція, за якою утворюється мономолекулярний шар адсорбованої речовини. На підставі термодинаміки –DG0 = A max = RTlnK, де Amax – робота адсорбції. Константа адсорбційної рівноваги визначається як K = де kадс – константа швидкості адсорбції; kдесорб – константа швидкості десорбції. Рівняння Ленгмюра можна вивести з рівняння Шишковського при диференціюванні На основі молекулярно-кінетичної теорії Ленгмюром було виведене рівняння: Г = Г¥ де Г¥ – максимальна адсорбція ПАР; Г – адсорбція при концентрації С; K – константа адсорбційної рівноваги.Вона чисельно дорівнює значенню константи b в рівнянні Шишковського. На кривій залежності адсорбції від концентрації чітко видні три ділянки: ділянка I – пряма лінія, що виходить з початку координат. Дійсно, з рівняння Ленгмюра при малих концентраціях КС<<1, і Г = Г¥KC; ділянка III – відповідає прямій, паралельній осі абсцис, що означає, що адсорбція досягла свого граничного значення, KС >>1 і Г = Г¥. Ділянка IIвідповідає криволінійній частини графіка й описується повним рівнянням Ленгмюра. Щоб знайти Г¥ і K в рівнянні Ленгмюра, його треба привести до лінійної форми. Для цього беруть зворотні значення правої і лівої частин рівняння й помножують на величину С:

Рис. 2. Залежність адсорбції від концентрації ПАР Лінійний графік рівняння Ленгмюра Тангенс кута нахилу b прямої до осі абсцис дає значення Побудувавши графік Проаналізуємо рівняння Ленгмюра і встановимо фізичний зміст константи. Якщо величина адсорбції складає половину максимальної адсорбції маємо: Г = 0,5 Г¥; 0,5 Г¥ = Г¥ тобто, ця константа дорівнює концентрації адсорбованої речовини, коли адсорбція досягає половини максимальної (граничної) адосорбції. Виходячи з величини граничної адсорбції знаходять товщину адсорбційного шару (довжину молекул ПАР) і площу, що займає адсорбована молекула. Площу знаходять за рівнянням S = (Г¥×N)−1, де N − число Авогадро. Товщину адсорбованого шару визначають за формулою d = Г¥×M×r−1, де M − молярна маса ПАР, r − його густина. Ленгмюр вивів рівняння для випадку адсорбції на поверхні рідини, але йго можна використовутати в усіх випадках мономолекулярної адсорбції. При адсорбції газів замість рівноважних концентрацій використовують рівноважні тиски. В 1908 році київский вчений Шишковський емпіричним шляхом установив, що константа K збільшується в 3-3,5 рази при подовженні ланцюга вуглеводневого радікалу на одну групу –СН2 і розрахував величину роботи адсорбції при збільшенні ланцюга на одну таку ланку. Вона виявилася рівної 3,2 кДж/моль. Таким чином, суть правила Дюкло-Траубе заключается в тому, що робота адсобції на кожну СН2-групу є сталою й близькою до 3,5 кДж/моль. Розташування молекул ПАР у поверхневому шарі енергетичне найбільш вигідне при умові занурення полярних груп (–ОН, –СООН, –NН2) у воду, а вуглецевих ланцюгів у неполярну фазу. При малій концентрації адсорбованих молекул у поверхневому шарі тепловий рух порушує її орієнтацію, і молекули в основному лежать у поверхневому шарі (рис. 3, а). При підвищенні концентрації підсилюється взаємодія вуглецевих ланцюгів, що сприяє їх орієнтації (рис. 3, б), а при повному насиченні адсорбційного шару утворюється мономолекулярний шар орієнтованих молекул (рис. 3, в). Рис. 3. Схема орієнтації молекул в поверхневому шарі Ці уявлення погоджуються з обчисленою товщиною насиченого адсорбційного шару, виходячи з максимальної адсорбції. Таким чином, при насиченні поверхневого шару на поверхні утворюється суцільний "молекулярний килим" (частокіл Ленгмюра) з молекул адсорбованої речовини. Товщина його мізерна, проте достатня, наприклад, для того, щоб помітним чином уповільнювати випаровування води. Такі плівки утворюють практично нерозчинні у розчиннику речовини. Для води нерозчинними є гомологи органічних сполук з великим числом атомів карбону в неполярних групах (наприклад, n > 12 для одноосновних жирних кислот). Приклад 4. На підставі даних адсорбції азоту на слюді визначити максимальну адсорбцію, константу адсорбційної рівноваги графічним методом. Р, мм рт. ст. 2,8 3,4 5,1 6,1 9,5 13,0 23,8 34 Г, мл/г 11,8 13,5 17,3 19,1 23,0 26,0 30,6 32,7 Розв’язання: Математичний вираз рівняння Ленгмюра наступний: Р, мм рт. ст. 2,8 3,4 5,1 6,1 9,5 13,0 23,8 34
Тангенс кута нахилу b прямої до осі абсцис дає значення tgβ = 0,025; Г∞ = 40 мл/г; 3. K − ? Z = 0,17; K = 1/40·0,17 = 0,15. Відповідь: Г∞ = 40 мл/г, K = 1/40·0,17 = 0,15. Приклад5.При адсорбції аргону коксованим вугіллям при 194,7 К експериментально отримали такі дані: Р, Па 3.20×103 13,12×103 29,06×103 Г, л/кг 2,00 6,15 9,58. Знайти сталі К та Гµ в рівнянні Ленгмюра. Розв'язання: Рівняння Ленгмюра для адсорції газів на твердих сорбентах таке: Г = Г¥
Р 3,20×103 13,12×103 29,06×103 tgj = З графіка Відповідь; Г¥ = 18,084 л/кг; b = 3,65× 10−5.
Поиск по сайту: |

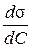 =
=  та підстановці в рівняння Гіббса (при цьому Г∞ =
та підстановці в рівняння Гіббса (при цьому Г∞ =  ).
). ,
,

 , а відрізок Z, що відрізається прямою на осі ординат – величину
, а відрізок Z, що відрізається прямою на осі ординат – величину  .
. = f(С), можна знайти граничну або максимальну адсорбцію (граничну ємність адсорбента) Г¥ та константу рівноваги K.
= f(С), можна знайти граничну або максимальну адсорбцію (граничну ємність адсорбента) Г¥ та константу рівноваги K. ; 0,5(K + C) = C; K = C,
; 0,5(K + C) = C; K = C, .
. 0,24 0,25 0,29 0,32 0,41 0,5 0,78 1,04
0,24 0,25 0,29 0,32 0,41 0,5 0,78 1,04 .
. За перетворенним рівнянням Ленгмюра
За перетворенним рівнянням Ленгмюра  будуємо графік
будуємо графік  = f(Р), з якого знаходимо Г¥, К.
= f(Р), з якого знаходимо Г¥, К. =
=  0,053, звідки Гµ = 18,86 л/кг.
0,053, звідки Гµ = 18,86 л/кг. = 1,45. Звідки К = 1:(1,45·103·18,86) = 3,65·10─5.
= 1,45. Звідки К = 1:(1,45·103·18,86) = 3,65·10─5.