 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Рівняння адсорбції ГіббсаСтр 1 из 3Следующая ⇒
Лекція № 5 Адсорбція з розчинів на міжфазній поверхні рідина – газ або рідина − рідина 1. Рівняння адсорбції Гіббса 2. Теорія мономолекулярної адсорбції Ленгмюра При цьому виді адсорбції розчинена речовина з розчину концентрується на поверхні рідини на границі з газом або іншою рідиною. Такі системи мають наступні особливості. 1. Поверхня рідини однорідна і, відповідно, рівноцінна для адсорбції; 2. Молекули адсорбата можуть вільно рухатися по поверхні рідини, тобто вони не скріплені з ділянкою поверхні, це означає, що адсорбція делокалізована; 3. Можна нехтувати впливом газової фази. Якщо рідини або гази не реагують між собою і взаємно не розчиняються, то на межі поділу між ними не спостерігається зміна поверхневого натягу більш щільної речовини. Якщо будь-яку речовину розчинити в рідкій фазі, то можуть спостерігатися три випадки. 1. Розчинена речовина концентрується на поверхні розділу фаз (Спов. > Срозч). Тоді спостерігається позитивна адсорбція, Г > 0. Поверхневий натяг розчину зменшується. Таку властивість мають молекули ПАР; 2. Розчинена речовина концентрується всередині фази, а на поверхні розділу концентруються молекули розчинника (Спов. < Срозч), адсорбція негативна (Г < 0). Поверхневий натяг розчину збільшується. Таку властивість мають молекули поверхнево-інактивних речовин, ПІР; 3. Розчинена речовина не змінює поверхневий натяг розчину, тому її концентрація по всьому обїєму розчинника стала (поверхнево-неактивні речовини, ПНР). Рівняння адсорбції Гіббса Джозеф Гіббс використав закони термодинаміки до повіерхневих явищ і, не виявляючи природи сил, що приводять до адсорбції речовин на границі розділу фаз і механізма явища, вивів рівняння залежності адсорбції від поверхневого натягу при зміні концентрації розчину. Математичний вираз рівняння Гіббса такий: Г = – де Г – надлишок кількості (адсорбція) розчиненої речовини на одиниці поверхні, моль/м2; С – її молярна концентрація, моль/л, s – поверхневий натяг розчину, Дж/м2. Це рівняння використовується для ідеальних розчинів (дуже розбавлених розчинів неелектролітів). Для реальних розчинів замість концентрацій треба вживати активність: Г = − Для газів замість концентрацій підставляють рівноважні тиски: Г = − Рівняння Гіббса універсальне і справедливе для всіх адсорбційних процесів, але поверхневий натяг можна визначати тільки для рідин, тому воно використовується саме у випадках адсорбції на поверхні поділу рідина − рідина або рідина − газ. Приклад 1.Знайти адсорбцію в моль/м2пеларгонової кислоти С8Н17СООН при 10 °С, якщо активність її в розчині 50 мг/л.Поверхневий натяг води при даній температурі дорівнює 74·10–3 Дж/м2, а розчину вказаної концентрації — 57,0 ·10–3 Дж/м2. Розв’язання: 1. Г – ?
Поиск по сайту: |
 ,
,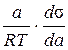 .
. .
.