|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Начальник управління організації. Медичної допомоги дітям і матерям Р.О
Медичної допомоги дітям і матерям Р.О. Моісеєнко
Додаток до Протоколу лікування дітей з лімфогранулематозом (хвороба Ходжкіна), затвердженого наказом МОЗ України від 20.07.2005 № 364
Дози і тип введення препаратів в циклі ОPРА
Дози і тип введення препаратів в циклі ОЕРА
Дози і тип введення препаратів в циклі СОРР
* Разом вводиться 200 мг/м2 MESNA (Уромітексан) у 0, 4, 8, годин по відношенню до початку інфузії Циклофосфаміду.
Схема блоку ВЕАСОРР
Схема блоку ВЕАСОРР + Г-КСФ (“підсилений”)
Ризик-фактори: а – велика (bulky) медиастинальна пухлина (>1/3 максимального поперечного діаметру грудної клітини) В – ураження екстралімфатичних зон с – ШОЕ >= 50 мм/год для „А”-стадій та >=30 мм/год для „В”-стадій d - 3 або більше уражених лімфатичних зон (не плутати з „лімфатичними регіонами” за класифікацією “Ann Arbor”!)
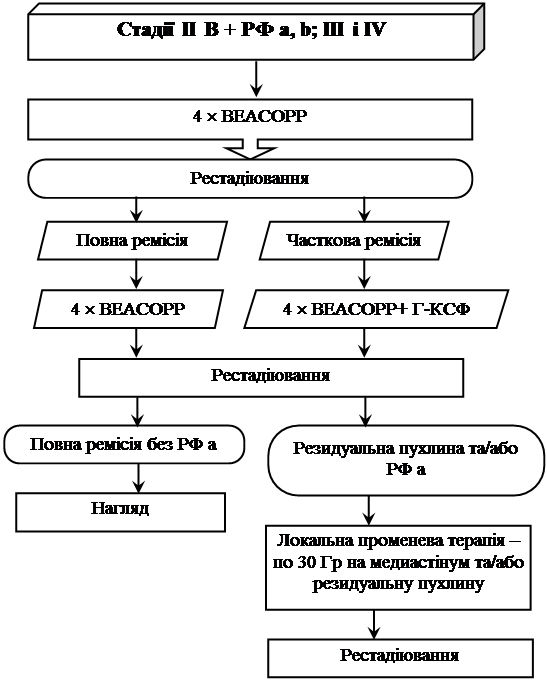
Схема лікування ЛГМ у дітей у відповідності до стадії захворювання (0 – 15 років)
* При значній резидуальній пухлині доза опромінення підвищується до 35 Гр.
Схема лікування хворих з продвиненими Стадіями захворювання (15 – 18 років) (HD 12)
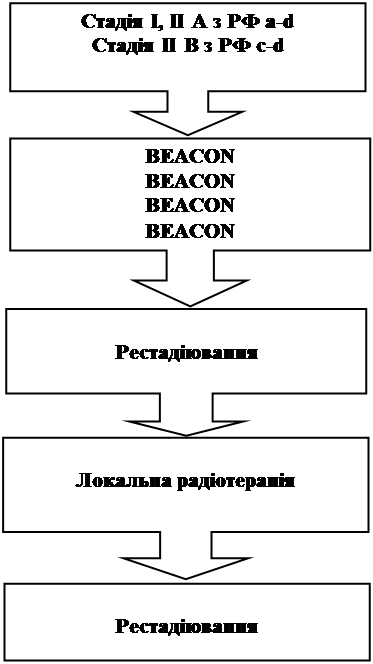
Схема лікування хворих з непродвиненими стадіями захворювання (15 – 18 років) (HD 11)
ПРОТОКОЛ ЛІКУВАННЯ ДІТЕЙ З ГОСТРИМИ МІЄЛОЇДНИМИ ЛЕЙКОЗАМИ Шифри МКХ-10: С 92.0, С 93.0, С 94.0 Гострі мієлоїдні лейкозивідносяться до досить поширених у дитячому віці онкологічних захворювань: частота їх в середньому становить 0,7 випадки на 100 000 дитячого населення на рік. Поняття „гострих мієлолейкозів” об’єднує групу захворювань, які за ВООЗ-класифікацією (сучасна модернізована ФАБ-класифікаційна система) розділяються на 8 варіантів: - М0 (гострий недиференційований мієлоїдний лейкоз); - М1 (гострий мієлобластний лейкоз без ознак диференціонування); - М2 (гострий мієлобластний лейкоз з ознаками диференціонування); - М3 (гострий промієлоцитарний лейкоз); - М4 (гострий мієломоноцитарний лейкоз); - М5 (гострий монобластний лейкоз); - М6 (гострий еритроцитарний лейкоз); - М7 (гострий мегакаріоцитарний лейкоз). В основі цих захворювань лежить неконтрольоване розмноження малігнізованих (лейкемічних) клітин-попередників мієлоїдного ряду у кістковому мозку з наступним їх розповсюдженням гематогенним шляхом. Найбільш характерною ознакою гострих мієлолейкозів є недостатність кістковомозкового кровотворення внаслідок витіснення нормальних кровотворних клітин малігнізованими, що проявляється розвиком анемії, тромбоцитопенії та нейропенії з відповідною клінічною симптоматикою. Проліферативний синдром є характерним лише для деяких варіантів захворювання (монобластний лейкоз, мієломонобластний лейкоз) і проявляється частіше у вигляді гепато/спленомегалії, ніж збільшенні лімфатичних вузлів, оскільки малігнізовані лейкемічні клітини мають тропність не до лімфатичної, а до ретикулоендотеліальної системи. З цим також пов’язані також такі характерні для гострих мієлолейкозів ознаки, як інфільтрація нирок, шкіри, ясен, тощо. Ургентні ситуації під час діагностики гострих мієлолейкозів можуть бути найчастіше пов’язані з неконтрольованими кровотечами та/або крововиливами у життєво важливі органи, а також з тяжкими інфекціями (сепсис з загрозою або навіть реалізацією сепсис-шоку). Обов’язковими діагностичними заходамиє пункція кісткового мозку з наступними цитологічним, цитохімічним, імуноцитологічними і цитогенетичним/молекулярно-генетичними дослідженнями лейкемічних (бластних) клітин (паралельно морфологічні дослідження також проводяться на бластних клітинах периферичної крові). Абсолютно необхідною є також здійснення діагностичної люмбальної пункції з вивченням ліквору на присутність лейкемічних клітин (бажано здійснення морфологічного дослідження клітин ліквору у цитоцентрифугаті, може проводитись також їх імуноцитологічний або цито/молекулярно-генетичний аналіз). Достатнім для діагнозу гострого мієлоїдного лейкозу є визначення у пункт аті кісткового мозку більше 20% лейкемічних клітин. Враховуючи складності у визначенні природи клітин, які мають морфологію „незрілих”, а також велику різноманітність морфологічних ознак лейкемічних клітин при різних варіантах гострих мієлолейкозів обов’язковим є проведення референції діагностичних морфологічних матеріалів у лабораторії, яка має значний досвід встановлення діагнозів гострих лейкозів. Прогностичне значення має визначення варіанту захворювання на основі морфо-цитохімічних даних і імуноцитологічних характеристик (варіанти М0 і М7 визначаються тільки на основі імуноцитологічного аналізу бластних клітин), наявність прогностично сприятливих чи, навпаки, несприятливих цитогенетичних аномалій, а також оцінка відповіді на терапію за швидкістю редукції бластних клітин в кістковому мозку при виконанні інтенсивного індукційного лікування. Лікування гострих мієлоїдних лейкозів є дуже складною лікувальною технологією, оскільки пов’язане з використанням інтенсивних програм поліхіміотерапії та необхідністю постійної профілактики і лікування викликаних як хворобою, так і терапією, небезпечних для життя хворого ускладнень (рівень летальності під час виконання протокольної хіміотерапії гострих лейкозів може становити 10%). Тому повноцінне куративне лікування хворих на гострий лейкоз повинно проводитись найбільш досвідченим медичним персоналом і тільки у відділеннях, які мають відповідну інфраструктуру (при цих умовах рівень безподійного виживання хворих може сягати 50 і більше %). За основу запропонованого лікувального протоколу прийнята остання версія німецького протоколу Групи BFM, в якій використовуються тільки елементи терапії, які вже довели свою максимальну ефективність у межах цієї терапевтичної стратегії і складається з одного (двох для пацієнтів групи високого ризику) індукційного курсів (AIE, HAM) консолідації ремісії двома блоками (AI, hAM), а також інтенсифікації (HD-AraC/VP-16,HAM). Особливості (зменшення загальної інтенсивності Протоколу і застосування цис-ретіноівої кислоти і індукційному періоді) має лікування хворих на гострий промієлоцитарний лейкоз (варіант М3), а також пацієнти з синдромом Дауна (виключення 2-ї індукції HAM з обсягу терапії, редукція дози Ідарубіцину, виключення краніального опромінення). Терапія супроводу при виконанні інтенсивної фази хіміотерапевтичного протоколу є дуже масивною і передбачає тотальну деконтамінацію кишковика, постійні трансфузії тромбоконцентрату і еритроцитарної маси, профілактичне та лікувальне застосування антибіотиків широкого спектру дії, антимікотичних препаратів, противірусних медикаментів, гепатопротекторів, кардиотропних ліків і ферментів, при необхідності – проведення часткового або тотального парентерального харчування. По закінченні інтенсивної фази поліхіміотерапії передбачається проведення опромінення головного мозку з чотирма інтратекальніми введеннями Цитарабіну і підтримуюча терапія 6-тіогуаніном щоденно з чотириденними блоками цитарабіну щомісяця. Пацієнтам групи високого ризику, які мають несприятливі цитогенетичні аномалії (моносомія (5), моносомія (7), інверсія (3), комплексні аномалії) та/або не досягли ремісії по закінченні 1-ї індукції пропонується виконання алогенної (при наявності HLA-сумісного донора) або аутологічної трансплантації стовбурових гемопоетичних клітин у першій ремісії захворювання. Хворим, які не досягли ремісії по закінченні 2-ї індукції, показаний перехід на сальваджну хіміотерапію з наступним виконанням процедури алогенної (при наявності донора) або аутологічної трансплантації стовбурових гемопоетичних клітин.
Лікування рецидивів гострих мієлоїдних лейкозів: - при ранньому рецидиві (менш ніж 1 рік після встановлення діалізу захворювання) показана протирецидивна терапія за схемою FLAG (Ida-FLAG, Mito-FLAG) або режими на базі використання низькодозового Цитарабіну з наступною алогенною трансплантацією стовбурових гемопоетичних клітин, (в окремих випадках може також розглядатися аутологічна трансплантація); - при пізньому рецидиві ( 1 рік та більше, з моменту встановлення діалізу захворювання) після здійснення протирецидивної терапії за однією з модифікацій схеми FLAG(або на базі використання низькодозового цитарабіну) та при наявності HLA-сумісного сімейного донора показане проведення алогенної трансплантації стовбурових гемопоетичних клітин, при відсутності сімейного донора після досягнення другої ремісії показане проведення аутологічної трансплантації стовбурових гемопоетичних клітин.
Начальник управління організації
Поиск по сайту: |