 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Судьба продуктов распада аминокислот
В отличие от углеводов и нейтральных жиров, при катаболизме которых образуются лишь СО2 и Н2О, при распаде аминокислот конечным продуктом, кроме вышеназванных веществ, является аммиак. Учитывая его вероятные токсические эффекты, следует остановиться на способах обезвреживания. Пути обезвреживания NН3 Свободный аммиак токсичен. Во-первых, он обладает хорошей растворимостью в воде, что сопровождается следующей реакцией:
Ее продукт - сильная щелочь, что грозит развитием алкалоза. Во-вторых, нарушается ЦТК, так как его метаболит – α-кетоглутарат – используется клеткой для нейтрализации гидроксида аммония. Образующаяся и накапливающаяся при этом глутаминовая кислота повреждает баланс аминокислот, в ЦНС ее гиперпродукция провоцирует декарбоксилирование, т.е. генез ГАМК, отсюда изменяется равновесие среди тормозных и возбуждающих медиаторов. Клинически накопление аммония (гипераммониемия) проявляется рвотой, судорогами, спутанностью и помутнением сознания, вплоть до комы. Поэтому в клетках существуют следующие механизмы, предотвращающие развитие этого явления: 1) Восстановительное аминирование:
2) Во многих тканях (головном мозгу, печени, почках, мышцах) обезвреживание осуществляется путем синтеза глутамина (реже аспарагина) - нейтрального нетоксического вещества, способного диффундировать через мембраны (одна из форм транспорта NН3).
Амидная группа глутамина часто используется в реакциях аминирования (в получении глюкозамина, галактозамина, заменимых аминокислот и т.д.) 3) Работа внутри- и внеклеточных буферных систем; с помощью которых нейтрализуется NН4ОН до солей аммония. Продукты обезвреживания аммиака (глн, асн, соли аммония) кровотоком доставляются в гепатоциты, где и происходит окончательная инактивация данного соединения: 4) Синтез мочевины. Мочевина – полный амид угольной кислоты, значит субстратами в ее образовании служат различные формы углекислоты (НСО3– или карбоксибиотин) и аммиака (амидная группа глутамина или соль аммония): Первая реакция:
протекает в митохондриях, здесь карбамоилфосфат взаимодействует с орнитином, служащим своеобразным катализатором, вследствие чего данный процесс известен как орнитиновый цикл синтеза мочевины:
образовавшийся при этом цитруллин, выходя из митохондрий изомеризуется в енольную форму:
Аргининосукцинат из-за наличия сильно поляризованных связей довольно легко разрушается с помощью аргининосукцинатлиазы:
Последний вновь связывается с молекулой карбамоилфосфата, начиная новый цикл. Суммарно:
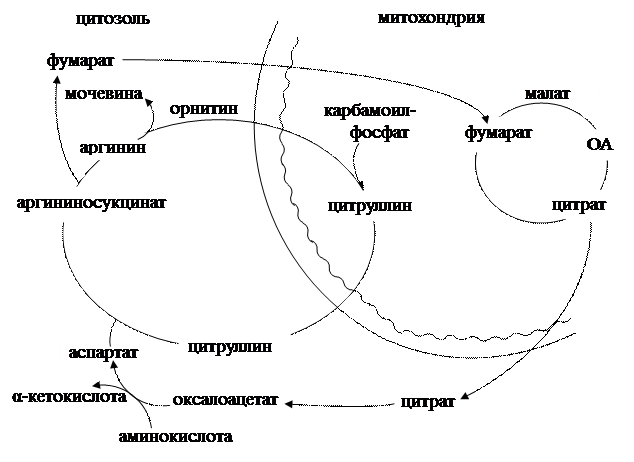
Подводя итог, следует заметить, что в целом мочевина собирает все атомы азота аминокислот: ее одна аминогруппа взята из аспартата, который может получиться путем переаминирования оксалоацетата с любой аминокислотой, другая же аминогруппа является производной аммиака, высвободившегося с помощью дезаминирования. Двухколесный велосипед Кребса – так называют исследователи два цикла, описанные Г. Кребсом из–за их тесной связи между собой (Схема 2.2.1.4.1). Цикл трикарбоновых кислот, тесно сопряженный с биологическим окислением и окислительным фосфорилированием, не только является поставщиком ОА для переаминирования в аспартат, но и дает СО2, НОН, АТФ для запуска и течения орнитинового цикла, одним из продуктов которого и является фумарат, служащий метаболитом ЦТК. Нормальное течение синтеза мочевины обеспечивает: 1. окончательное обезвреживание аммиака; 2. избавление организма от NH3 и CO2; 3. баланс рН, поддерживая гомеостаз бикарбонатной буферной системы. Для контроля нормального течения метаболизма азотсодержащих соединений, и в основном, процессов обезвреживания аммиака в клинике
Схема 2.2.1.4.1. Взаимосвязь между ЦТК с орнитиновым циклом. служит определение в крови следующего показателя - остаточного азота (Rest W) – т.е. оценивается суммарное содержание низкомолекулярных азотистых веществ, которые остаются фильтрате после осаждения белков. В их общем количестве около половины приходится на мочевину, 25% составляет доля аминокислот, величины креатина укладываются в 5%, ураты в 4% и т. д. В норме значения остаточного азота колеблются в пределах 14–25 ммоль/л, у новорожденных они выше (42–71 ммоль/л). При различных патологических состояниях регистрируется гиперазотемия. В зависимости от механизмов возникновения выделяют продукционную и ретенционную гиперазотемии. Первый вариант может быть спровоцирован систематическим избыточным поступлением пищевых белков (у «мясоедов»), усиленный деструкцией тканей, сопровождающейся ускоренным распадом белков (при опухолях, лейкозах, ожоговой болезни и т.д.). Основной причиной ретенционной гиперазотемии служат обычно болезни почек при нарушении их выделительной способности, что обуславливает избыточное накопление в плазме крови мочевины. Кроме того, рост величин остаточного азота может наблюдаться при сердечно–сосудистой декомпенсации, при непроходимости кишечника (усилено всасывание продуктов гниения), сахарном диабете и т.д. В последние годы стали проводить количественное определение отдельных компонентов остаточного азота – аминокислот (например, гипер-аминоацидемия при усиленном гидролизе тканевых белков распадающихся тканей) и мочевины (гиперкарбамидемия при болезнях почек). Гипокарбамидемия встречается довольно редко, обычно это следствие мутаций ферментов – участников орнитинового цикла (см. «Патохимия наследственных болезней» С. 57). Анаболизм аминокислот Появление аминокислот (см. Приложение, т.1) в клетке может носить двойной характер. Для основной их части требуется поступление в организм в составе пищевых белков. Если пропорции содержащихся в них аминокислот близки к таковым у человека, то в кишечнике происходит их полное усвоение, поэтому такие протеины называют полноценными; те же аминокислоты, анаболическая фаза носит экзогенный характер, называются незаменимыми (фен, лей, иле, лиз, мет, три, тре, вал). К заменимым относят 8 их аналогов, они могут всасываться в кишечнике после переваривания белков и могут синтезироваться в тканях человека. Для некоторых аминокислот этот процесс очень прост – переаминирование. Таким способом легко получить из
где ТГФК – активная форма фолиевой кислоты (витамина Вс). Восемь заменимых аминокислот (ала, сер, гли, глу, асп и т. д.) легко получаются также при преобразованиях глюкозы и метаболитов гликолиза, ЦТК. Глутаминовая кислота после некоторых реакций может циклизоваться в пролин. Некоторые аминокислоты относят к условно заменимым, т.е. тем, синтез которых зависит строго от конкретных соединений: Тирозин – продукт гидроксилирования только фенилаланина, аргинин является метаболитом орнитинового цикла синтеза мочевины, цистеин получается из метионина. 2.4. Особенности обмена отдельных аминокислот. Общим для большинства аминокислот является использование их в генезе белков, поэтому такие представители называют протеиногенными. Но в клетках регистрируются их аналоги, которые не обнаруживаются в полипептидных цепях. Например, орнитин, цитруллин – метаболиты только орнитинового цикла синтеза мочевины, ГАМК – медиатор, гомоцистеин – продукт метаболизма метионина, β–аланин – компонент HSKoA и т.д. Протеиногенные аминокислоты также, кроме своей вышеназванной основной роли и преобразования в свои аналоги, выполняют специфические, характерные только для них функции. Самый простейший представитель – глицин – служит субстратом в синтезе гема – простетической группы гемопротеидов (гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов), пуриновых оснований (аденина, гуанина – главных компонентов нуклеотидов), включается в состав парных жёлчных кислот (гликохолевой, гликодезоксихолевой кислот), участник генеза креатина, который в мышцах в виде креатинфосфата является макроэргом. Между глицином и серином существуют тесные взаимоотношения: первая аминокислота, содержащая два углеродных атома с помощью С1-ТГФК легко увеличивается на один атом углерода, преобразуясь в серин последний, в свою очередь, после декарбоксилирования становится этаноламином, который метилируясь дает холин. Все три соединения являются обязательными компонентами липидов: глицеро – и сфингофосфатидов. В метаболизме аланина особая специфика отсутствует. Он, как и многие другие аминокислоты (глу, асп, сер, фен, тир, гли и др.), может использоваться гликонеогенезе, а один из его метаболитов ДГАФ, восстанавливаясь становится глицерол–1–фосфатом – обязательным компонентом нейтральных жиров и глицерофосфатидов. Образующийся после трансаминирования аланина пируват (основной субстрат в ГНГ) в митохондриях может подвергнуться окислительному декарбоксилированию, продукт которого ацетил-КоА или распадается в ЦТК, или идет на генез кетонового тел, или служит субстратом в синтезе ВЖК либо холестерина, или на реакции ацетилирования (синтез ацетилхолина, ацетилгалактозамина и др.) Глутамат (или его амид) и аспартат необходимы в орнитиновом цикле мочевины (окончательном обезвреживании NH3), участники синтеза пуриновых, а аспартат – и пиримидиновых нуклеотидов. Глутамат может образовывать циклическую иминокислоту – пролин, аминогруппа глутамина часто используется в реакциях аминирования моносахаридов (в получении глюкозамина, галактозамина и т.д.). Интересно, что глутаминовая кислота, как и глицин способна выполнять функцию нейромедиаторов. Специфичны преобразования аргинина поступающего или с пищей, или получающегося в орнитиновом цикле синтеза мочевины. Он является обязательным участником синтеза креатина (приложение табл. 8), а также от этой аминокислоты под действием NO – синтазы, может отщепляться радикал ·NO - биологически активная структура, регулирующая сердечные сокращения, тонус сосудов. Подобный эффект, но более длительный, оказывают органические нитропроизводные (нитроглицерин, нитросорбид и т.д.), используемые в клинике сердечно-сосудистых заболеваний. Из серосодержащих аминокислот заменимой является цистеин, который получается после взаимодействия серина и метионина; включаясь в белки, укрепляет их структуру, за счет образования бисульфидных мостиков (в составе кератина, эластина, коллагена). Входя в активные центры различных ферментов, за счет HS-группы непосредственно участвует в обеспечении каталитической функции. Распад цистеина (приложение, табл. 5) может закончиться образованием таурина и сульфатов. Первый является антиоксидантом. Но выше названное соединение выполняет еще одну функцию, входя в состав парных желчных кислот (таурохолевой, тауродезоксихолевой), облигатных участников переваривания липидов. Необходимый в реакциях ацилирования коэнзим включает в свою молекулу HS-группу, меркаптоэтиламина, получившегося из цистеина. В организме присутствуют энзимы, с помощью которых сульфгидрильная группа последнего окисляется до сульфатов, активная форма которых– ФАФС (фосфоаденозинфосфосульфат) – используется в реакциях сульфирования (получении сульфатированных липидов, гетерополисахаридов), при обезвреживании в печени. Метиотин – условно заменимая аминокислота: ее основная доля имеет экзогенное происхождение, а небольшой процент получается из гомоцистеина с помощью метионинсинтазы, использующей в качестве донора метильной группы – Н3С-ТГФК (Метил-тетрагидрофолиевую кислоту). Особая роль принадлежит метионину в синтезе белков. Образование любой полипептидной цепи начинается с этой аминокислоты, но в конце трансляции происходит ее отделение от получившегося протеина, иными словами в клетках регистрируется очень малое количество метионинсодержащих полимеров. Их примером могут быть метионинэнкефалины – «гормоны счастья». С другой стороны, с помощью взаимодействия с АТФ из этой аминокислоты получается макроэрг - SAМ (S-аденозилметионин), который служит источником метильных групп в синтезе креатина, карнитина (с его помощью ацилы ВЖК преодолевают мембраны митохондрий), холина (компонента холинфосфатидов, ацетилхолина), адреналина, ансерина. (приложение, табл. 6, 7). Схема 9 (см. «Патохимия наследственных болезней» С. 67) обмена серосодержащих аминокислот показывает, как SAМ в результате метилирования преобразуется в S-аденозилгомоцистеин, который гидролизуется до аденозина и S-гомоцистеина. Последний может использоваться или для синтеза метионина, или через цистатионин превращаться в цистеин. Если какая-либо из этих реакций угнетена, происходит накопление этой аминокислоты, что для организма опасно, вызывая ряд патологических эффектов. В последние годы исследователи считают, что гипергомоцистеинемия – более серьёзный фактор риска развития болезней сердечно-сосудистой системы, чем холестерин. Это обусловлено тем, что гомоцистеин повреждает стенки сосудов, делая их поверхность рыхлой, что облегчает осаждение и внедрение холестерина, ионов кальция, образуя атеросклеротическую бляшку. Кроме того, установлено, что данное соединение тормозит работу потивосвертывающей системы, повышение его уровня может быть причиной бесплодия и невынашивания беременности, рождения детей с пороками развития, нарушений когнитивных функций, психических расстройств. Циклические аминокислоты – в основном, протеиногенные, но служат также и для синтеза других соединений. Фенилаланин и продукт его гидротации тирозин в меланоцитах преобразуются в меланины, защищающие кожу о различных лучевыхпоражений. Из этих же аминокислот синтезируются биологически активные вещества: тироидные гармоны, фенилэтиламин, тирамин, кетохоламины (дофамин, нададреналин, адреналин). Все преобразования в норме и патологии представлены в схеме (Приложение, табл. 8; см. «Патохимия наследственных болезней» С. 60). Подобная схема (схема 8, см. «Патохимия наследственных болезней» С. 66) иллюстрирует процессы метаболизма триптофана, главным является кинурениновый путь (Приложение, табл. 10), конечными его продуктами служат: НАД+ и НАДФ+ - коферменты дегидрогеназ. Кроме того, триптофан может преобразовываться в следующие биологически активные амины: серотонин, триптамин, мелатонин. О катаболизме гистидина можно судить по схеме 7 (см. «Патохимия наследственных болезней» С. 64).После декарбоксилирования этой аминокислоты получается гистамин – сосудорасширяющее вещество, способствующее боли, воспалительной реакции. Своим присутствием в активном центре ферментов гистидин увеличивает его нуклеофильность (в рибонуклеазе, химотрипсине, фосфолипазе). Кроме того, эта аминокислота входит в состав дипептидов: карнозина и ансерина – АО, предотвращающих поражение функций митохондрий.
Тесты к главам 1, 2. 1. Укажите низкомолекулярные азотсодержащие соединения: *а) аденин; *б) гем; в) рибоза; *г) глицин; д) гемоглобин. 2. Укажите эндопептидазы: *а) трипсин; б) дипептидаза; в) рибонуклеаза; *г) пепсин; *д) химотрипсин. 3. Для каких ферментов оптимальна щелочная среда: *а) трипсин; б) пепсин; *в) химотрипсин; *г) эластаза; *д) карбоксиполипептидаза. 4.Какие ферменты гидролизуют пептидные связи, в образовании которых принимают участие ароматические аминокислоты: а) трипсин; *б) пепсин; в) рибонуклеаза; *г) химотрипсин; д) эластаза. 5. Укажите вероятные продукты гниения в кишечнике: *а) скатол; б) аденин; *в) Н2S; *г) NH3; *д) путресцин. 6. Физиологические пути всасывания продуктов гидролиза белка в кишечнике: *а) облегченная диффузия; б) пиноцитоз; в) активный транспорт; г) фильтрация; д) пассивная диффузия. 7. Происхождение цитоплазматических аминокислот: *а) результат их всасывания в энтероцитах; *б) продукт распада тканевых белков; в) продукт гниения в кишечнике; *г) синтез из альфа-кетокислот; д) субстраты синтеза белков. 8. Укажите варианты реакций лишения аминогруппы аминокислотой: а) декарбоксилирование; *б) переаминирование; *в) дезаминирование; г) аминирование; д) гидролиз. 9. Укажите возможные продукты дезаминирования аминокислот в клетке: а) β-оксикислоты; б) аминоспирты; *в) α-кетокислоты; г) ароматические основания; д) биогенные амины. 10. Укажите витамины, активная форма, которого служит коферментом аминофераз: а) В1; б) В2; в) В3; г) В5; *д) В6. 11. Один из вариантов распада каких аминокислот напоминает обмен пирувата: *а) триптофан; *б) тирозин; *в) фенилаланин; г) пролин; *д) гистидин. 12. Судьба СО2 в организме: *а) компонент буферной системы; б) вхождение в состав витамина В1; *в) связывание с биотином; *г) использование в синтезе ВЖК; *д) выделение из организма. 13. Перечислите биологически активные амины: *а) гистамин; б) этаноламин; *в) фенилэтиламин; г) глицин; *д) дофамин. 14. Укажите конечные продукты распада аминокислот: *а) Н2О; *б) СО2; *в) мочевина; *г) соли аммония; д) СН4. 15. Укажите аминокислоты – непосредственные участники синтеза мочевины: *а) асп; *б) цитруллин; в) гистидин; *г) аргинин; *д) орнитин. 16. Какой метаболит синтеза мочевины отправляется в ЦТК? *а) аргинин; б) ОА; *в) фумарат; г) малат; д) глутамат. 17. Где осуществляется орнитиновый цикл синтеза мочевины? а) в почках; б) в кишечнике; в) в головном мозге; *г) в печени; д) в мышцах 18. Как называется повышенное содержание мочевины в плазме крови? а) гиперазотемия; б) гипокарбамидемия; в) нормогликемия; г) гипоазотемия; *д) гиперкарбамидемия. 19. Укажите варианты гиперазотемии: *а) продукционная; б) концентрационная; *в) ретенционная; г) фильтрационная; д) гидролитическая. 20.Перечислите компоненты остаточного азота: *а) аминокислоты; *б) мочевина; *в) соли аммония; *г) креатин; д) лактат. 21. Укажите аминокислоты, способные синтезироваться в организме: а) лей; *б) сер; *в) арг; г) три; *д) асп. 22. Из каких соединений синтезируются аминокислоты: а) β-кетокислоты; *б) α-аминокислоты; в) ВЖК; *г) α-кетокислоты; д) ацетил - КоА. 23. Укажите аминокислоты, которые не являются протеиногенными: *а) орнитин; *б) гомоцистеин; *в) цитруллин; г) аспарагин; д) аланин. 24. Какая аминокислота является компонентом парных желчных кислот: а) ала; б) гистидин; *в) гли; г) аспарагин; д) серин. 25. Какие аминокислоты – участники синтеза креатина: а) орнитин; *б) аргинин; *в) глицин; *г) метионин; д) лейцин. 26. Какая аминокислота включается в гем? а) треонин; б) гистидин; в) аланин; *г) глицин; д) аргинин. 27. Избыточная концентрация в крови какой аминокислоты является фактором риска патологии сердечно-сосудистой системы: а) треонина; б) метионина; в) цистеина; г) цистина; *д) гомоцистеина. 28. Преобразование какой аминокислоты заканчивается образованием НАДФ? а) глобулина; б) аргинина; в) карнитина; *г) триптофана; д) тирозина. 29. Какие соединения могут синтезироваться из фенилаланина? *а) тироксин; *б) меланин; *в) адреналин; *г) фенилэтиламин; д) пролин. 30. Блок какого фермента характерен для фенилкетонурии? а) дофамингидроксилаза; б) тир-аминофераза; *в) фенилаланин-4-гидроксилаза; г) фенилаланин-аминофераза; д) фенилаланин-ДГ. 31. Генетический дефект в обмене какой аминокислоты приводит к развитию синдрома Хартнупа? а) гистидина; *б) триптофана; в) тирозина; г) метионина; д) аспартата. 32. Какое вещество выделяется с мочой при алкаптонурии? а) фумарат; б) таурин; *в) гомогентизинат; г) фениллактат; д) пируват. 33. Укажите варианты наследственной патологии триптофана: а) олигофрения фенилпирувика; *б) синдром Прайса; *в) синдром Кнаппа– Комровера; *г) синдром голубых пеленок; д) синдром Леш-Найхана.
Поиск по сайту: |




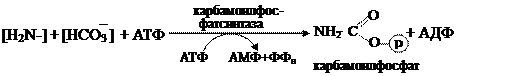



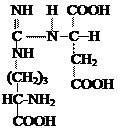



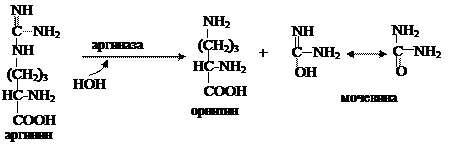 Продукт данной реакции фумарат обычно отправляется в митохондрии, где включается в ЦТК, а аргинин гидролизуется до мочевины и орнитина.
Продукт данной реакции фумарат обычно отправляется в митохондрии, где включается в ЦТК, а аргинин гидролизуется до мочевины и орнитина.



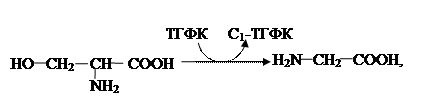 Оригинальны отношения между серином и глицином:
Оригинальны отношения между серином и глицином: