 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Фотоэффект – явление изменения энергии электронов вещества под действием света
При внешнем фотоэффекте электроны вылетают с поверхности металлов. На основе опытов были установлены законы внешнего фотоэффекта. 1. Максимальная скорость электронов прямо пропорциональна частоте падающего света (но не зависит от интенсивности света): 2. Число вылетающих электронов пропорционально интенсивности падающего света (освещенности катода): 3. Свет не любой частоты вызывает фотоэффект из данного вещества. Для каждого вещества существует минимальная частота света νmin (максимальная длина волны λкр), при которой еще наблюдается фотоэффект. Эти частоты (или длина волны) называются красной границей фотоэффекта. Падающие фотоны поглощаются электронами вещества. Энергия фотона
Это соотношение называется уравнением Эйнштейна для фотоэффекта. Из этого соотношения вытекают все законы фотоэффекта. Работа выхода для данного металла постоянна, поэтому скорость электронов зависит от энергии фотона, т.е. от частоты света. Интенсивность света:
При падении света, согласно волновой теории, на поверхность оказывается давление: По квантовой теории давление света объясняется наличием импульса у фотонов. По II закону Ньютона: Таким образом, свету присущ дуализм (двойственность) свойств. В явлениях интерференции, дифракции, поляризации, дисперсии ярче проявляются волновые свойства. Фотоэффект, давление света, эффект Комптона подтверждают квантовую природу излучения. Позже двойственность свойств была открыта у электронов и других элементарных частиц. Этот факт получил название корпускулярно-волнового дуализма. Опыты Резерфорда. Планетарная модель атома. Модель Бора и ее историческая роль
До конца ХIХ в. считали, что атомы – неделимые мельчайшие частицы вещества. Открытие электрона показало, что эта отрицательная заряженная частица примерно в 2000 раз меньше атома и входит в состав атома. А т.к. атом нейтральный, то, значит, в его состав входят и положительные заряженные частицы. Первые попытки создания модели атома принадлежат У. Томсону и Дж. Дж. Томсону. В 1902 г. У.Томсон (лорд Кельвин) предложил кексовую модель, согласно которой атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Позднее было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно. В 1910–1911 гг. Э. Резерфорд с сотрудниками провел опыты по зондированию атомов с целью выяснения характера распределения положительных и отрицательных зарядов в атоме. Для этого узкий пучок a-частиц, испускаемых радиоактивным веществом, направлялся на тонкую металлическую фольгу, за ней помещался экран, который был покрыт сернистым цинком и при соударение с a-частицами экран светился. Вызываемые ударами a-частиц вспышки света наблюдались в микроскоп. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги. Эти опыты показали, что a-частицы, обладая большой проникающей способностью, пролетали через фольгу и рассеивались на разные углы. В некоторых случаях угол рассеивания j превышал 900. Объяснить это можно было взаимодействием a-частиц с положительным зарядом атома. Причем этот заряд должен занимать малый объем и обладать большой массой. На основании этих опытов Резерфорд предложил ядерную модель строения атома. Согласно Резерфорду, атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющее размеры, не превышающие 10-14 м, а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре. Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Э.Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны и иметь сплошной спектр излучения. Процесс излучения сопровождается потерей энергии, так что электрон должен, в конечном счете, упасть на ядро. Из опыта известно, что атомы – это устойчивые образования, а спектр их излучения линейчатый, а не сплошной. Для объяснения противоречий модели строения атома опытным фактам датский физик Нильс Бор в 1913 г. обобщил гипотезу Планка о квантах для любой атомной системы. В основе теории Бора лежат постулаты: I. Атомы и атомные системы могут длительное время находиться в определенных состояниях, называемых стационарными, при этом атом не излучает и не поглощает энергию. Энергии стационарных состояний образуют дискретный ряд Е1, Е2, Е3,… II. Атомы излучают или поглощают энергию при переходе из одного стационарного состояния в другое, при этом квант излучаемой или поглощаемой энергии определяется соотношением: hv=En–Em, где En , Em – энергии стационарных состояний, между которыми произошел переход. III. В атоме осуществляются такие орбиты электрона, для которых момент импульса Идея Бора о существовании в атомах стационарных состояний была подтверждена опытами Дж. Франка и Г. Герца. Теория Бора положила начало развитию квантовой теории строения атома.
Поиск по сайту: |
 .
. .
. частично тратится на освобождение электрона из вещества (работу выхода), а частично превращается в кинетическую энергию электрона:
частично тратится на освобождение электрона из вещества (работу выхода), а частично превращается в кинетическую энергию электрона:
 – работа выхода электрона из металла.
– работа выхода электрона из металла. , а каждый фотон может выбить один электрон. Поэтому число вылетающих электронов определяется интенсивностью падающего света. И, наконец,
, а каждый фотон может выбить один электрон. Поэтому число вылетающих электронов определяется интенсивностью падающего света. И, наконец,  , тогда электрон не может покинуть вещество, фотоэффект не наблюдается. Поэтому из условия:
, тогда электрон не может покинуть вещество, фотоэффект не наблюдается. Поэтому из условия:  можно определить, красную границу фотоэффекта. Т.к.
можно определить, красную границу фотоэффекта. Т.к. 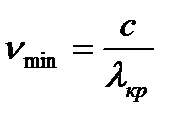 , то:
, то:
 , где I – интенсивность света, R – коэффициент отражения. Для черной поверхности R = 0 Þ
, где I – интенсивность света, R – коэффициент отражения. Для черной поверхности R = 0 Þ  . Для белой поверхности R=1 Þ
. Для белой поверхности R=1 Þ  . Экспериментально световое давление было обнаружено и измерено в опытах П.Н.Лебедева.
. Экспериментально световое давление было обнаружено и измерено в опытах П.Н.Лебедева. , где ΔРфот – изменение импульса фотонов, падающих на поверхность. Давление по определению
, где ΔРфот – изменение импульса фотонов, падающих на поверхность. Давление по определению  . Если S=1 м2, Δt=1с, то численно р = ΔРфот. Если поверхность черная, то изменение импульса первого фотона
. Если S=1 м2, Δt=1с, то численно р = ΔРфот. Если поверхность черная, то изменение импульса первого фотона  , а для N фотонов
, а для N фотонов  . Поэтому, т.к.
. Поэтому, т.к.  ,
,  . Если поверхность белая – удар фотона упругий. Изменение импульса первого фотона
. Если поверхность белая – удар фотона упругий. Изменение импульса первого фотона  , а для N фотонов
, а для N фотонов  . Эти выводы соответствуют и волновой теории.
. Эти выводы соответствуют и волновой теории. , где n =1, 2, 3 - главное квантовое число, а ħ – постоянная Планка.
, где n =1, 2, 3 - главное квантовое число, а ħ – постоянная Планка.