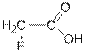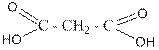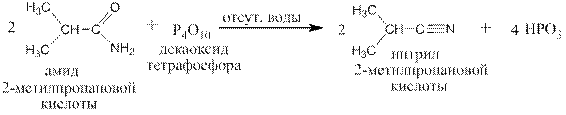|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Медико-биологическое значение карбоновых кислот
Многие карбоновые кислоты с чётным количеством атомов углерода в молекуле входят в виде фрагментов в состав животных жиров и растительных масел, поедаемых с пищей. В организме жиры подвергаются гидролизу, при котором образуются эти кислоты в свободном виде, а затем часть из них идёт на строительство собственных запасных жиров человека или на синтез жиров молока. В молочных железах из одних, более длинных карбоновых кислот получаются другие, более короткие: масляная, капроновая, каприловая, каприновая. Наиболее часто в жирах встречаются кислоты С18: стеариновая:
олеиновая:
линоленовая:
и C16: пальмитиновая:
и пальмитолеиновая:
. Арахидоновая кислота:
содержится в организме в очень малых количествах, но играет большую роль в синтезе гормонов. Линолевая, линоленовая и арахидоновая кислоты являются для организма человека незаменимыми, так как отсутствие их в пище приводит к патологическим изменениям, например, к возникновению дерматитов. Незаменимые жирные кислоты предупреждают и излечивают дерматиты, причём наиболее активна арахидоновая кислота (в 10 раз по сравнению с суммой линолевой и линоленовой кислот). Больше всего арахидоновой кислоты в арахисовом масле, меньше в кукурузном, кунжутном, соевом и хлопковом маслах. Некоторые авторы считают незаменимые жирные кислоты (НЖК) витаминами. Фрагменты НЖК находятся в фосфолипидных тканях животных и человека, в составе лецитина почек, кефалина мозга. Запасный жир человека в норме содержит 8,2-11% линолевой кислоты и 0,3-1% арахидоновой кислоты. Многие карбоновые кислоты являются фармацевтическими препаратами. Так, например, две карбоновые кислоты, содержащие в своей структуре йод, являются рентгеноконтрастными препаратами и применяются за 12-14 часов до рентгеновского исследования желчных путей и желчного пузыря.
кислота йопаноевая (йопагност, холевид) 2-(3’-Амино-2’,4’,6’-трийодбензил)бутановая кислота
кислота йомегламовая (фалигност) N-метил-N-(3-амино-2,4,6-трийодфенил)амид глутаровой кислоты. Многие широкоприменяемые фармацевтические препараты являются кислотами. Например, аспирин, он же ацетилсалициловая кислота:
Более сильным жаропонижающим и противовоспалительным средством, чем аспирин, является мефенамовая кислота:
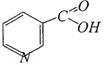
Витамин PP или никотиновая кислота (пиридин-3-карбоновая кислота)
обладает противопеллагрическим эффектом, улучшает углеводный обмен, действует положительно при лёгких формах диабета, заболеваниях печени и сердца. Индометацин (метиндол):
1-(п-хлорбензоил)-5-метокси-2-метилиндол-3-уксусная кислота Это соединение является активным противовоспалительным препаратом, применяемым, например, при ревматоидном артрите, подагре, тромбофлебите и других заболеваниях, сопровождающихся воспалением. В справочнике Машковского описаны десятки других препаратов, являющихся производными карбоновых, дикарбоновых кислот и их солей.
Химические свойства карбоновых кислот.
Карбоновые кислоты являются слабыми кислотами. В воде они обратимо диссоциируют на карбоксилат-ионы и катионы водорода:
Это равновесие характеризуется константой кислотной диссоциации – Ka
Логарифмируя выражение (I) с помощью десятичных логарифмов, получим:
Меняя в выражении (II) знаки на противоположные и учитывая свойства логарифмов, получим:
Вводя обозначения
Очевидно, что если Условие Отсюда следует, что pKa это то значение pH, при котором кислота диссоциировала наполовину или, другими словами, то значение pH среды, при котором концентрация недиссоциированной формы кислоты равна концентрации её аниона. Величина pKa принята за меру силы кислот, в том числе карбоновых. На силу карбоновых кислот влияют характер радикала, наличие в нём заместителей. Так, например, электроноакцепторные заместители увеличивают силу кислот (уменьшают pKa), а донорные уменьшают. Например, pKa (H2N - CH2 - COOH)=9.78, а pKa (F3C - COOH)=0.23. Таким образом, трифторуксусная кислота сильнее аминоуксусной в 109, то есть в миллиард раз.
Влияние заместителей на pKa производных уксусной кислоты
pKa дикарбоновых кислот. Зависимость от длины углеродной цепи
Обращает на себя внимание такой факт, что остаток ацетилена (то есть атом углерода в состоянии sp-гибридизации) влияет сильнее, чем введение одной нитрогруппы в качестве заместителя. Удаление заместителя по углеродной цепи далее четвертого атома перестаёт сказываться на pKa. Это видно по таблице pKa дикарбоновых кислот. Знание величины pKa позволяет решать вопрос о возможности вытеснения одной кислоты действием другой: если разница в pKa составляет одну единицу, то соотношение между кислотами в растворе будет 1:10, например:
То есть реакция (2) пойдёт практически до конца, реакция (1) до установления равновесия (≈1:10), а реакция (3) практически не пойдёт.
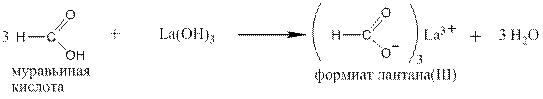
1. Как кислоты карбоновые кислоты вступают в реакции: 1.1 С металлами, стоящими в ряду напряжений до водорода:
Безводные жидкие кислоты можно вводить в реакции со щелочными металлами, Sr и Ba, которые в водных растворах реагируют и с водой:
1.2 Со щелочами (реакция нейтрализации):
1.3 С нерастворимыми в воде основаниями:
1.4 С амфотерными гидроксидами:
1.5 С основными оксидами:
1.6 С амфотерными оксидами:
1.7 С солями более слабых кислот:
1.8 С солями нестойких кислот:
2. Действием галогенидов неметаллов или оксигалогенидов неметаллов из карбоновых кислот получаются их галогенангидриды:
3. Действием декаоксида тетрафосфора (фосфорного ангидрида) из карбоновых кислот получаются их ангидириды:
4. Карбоновые кислоты мгновенно реагируют с аммиаком и аминами, давая соли:
При нагревании этих солей отщепляется вода, и получаются амиды или алкиламиды:
Соли триалкиламмониев при тех температурах, при которых аммонийные, моноалкиламмонийные и диалкиламмонийные соли разлагаются с получением соответствующих амидов или алкиламидов и воды, не разлагаются, а при температурах выше 200оС разлагаются, давая сложную смесь низкомолекулярных продуктов. Действием на амиды P4O10 получают нитрилы:
Поиск по сайту: |
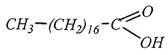

 линолевая:
линолевая:









 (I)
(I) (II)
(II) (III)
(III)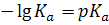 и
и  , получим:
, получим: (IV)
(IV) , то pKa=pH.
, то pKa=pH. , а это в свою очередь, если [R-COOH] = [R-COO-].
, а это в свою очередь, если [R-COOH] = [R-COO-].