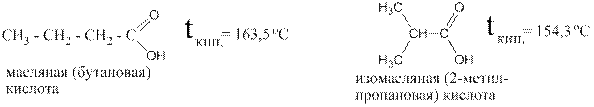|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Физические свойства карбоновых кислот
1.1 Отношение к свету. Карбоновые кислоты представляют собой бесцветные вещества, поглощающие свет в ближней ультрафиолетовой части спектра. Так, например, уксусная кислота неинтенсивно (εmax = 40) поглощает свет с длиной волны λmax = 204нм. Ароматические карбоновые кислоты поглощают свет при больших длинах волн. Например, бензойная при 270нм. Карбоновые кислоты, у которых карбоксильная группа сопряжена с системой чередующихся двойных и простых связей, не только поглощают свет при более длинных волнах с увеличением системы, но растёт также и интенсивность поглощения:
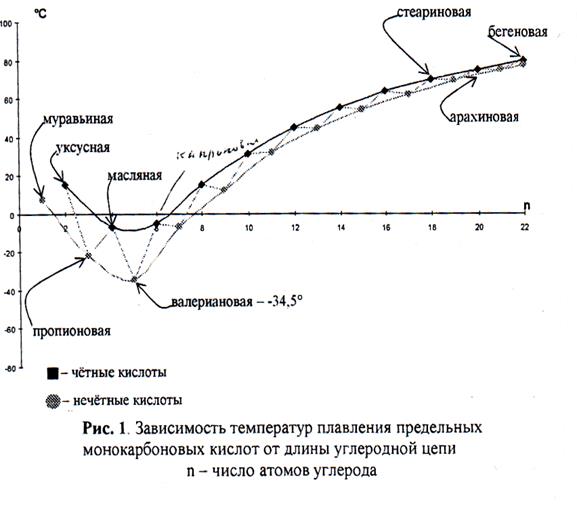
1.2 Агрегатное состояние Среди алифатических карбоновых кислот при нормальных условиях нет газообразных и только пять из них являются жидкостями, а остальные - твёрдыми веществами. Зависимость температур плавления предельных монокарбоновых кислот от длины углеродной цепи имеет ряд интересных особенностей. Так для чётных и нечётных кислот, как видно из рис. 1, можно провести две разные кривые, каждая из которых является кривой с минимумом. Если соединить все точки на графике по порядку увеличения числа атомов углерода, то получается ломаная линия, на которой соседние точки сближаются по оси ординат с ростом n (ось абсцисс).
Так, например, экспериментальное определение молярной массы уксусной кислоты в парах (по методу Дюма) даёт до 250°С значение 120 г/моль. И только выше (от 250°С до 280°С) эта масса постепенно уменьшается и становится равной теоретической, то есть 60 г/моль. Это означает, что димеры очень прочны, существуют не только в растворе, но и долго наблюдаются в парах. Аналогичные димеры существуют и для других карбоновых кислот. Температуры кипения у предельных монокарбоновых кислот монотонно увеличиваются с ростом углеродной цепи:
Как и у альдегидов и кетонов, разветвлённые кислоты всегда кипят заметно ниже изомерных им линейных кислот. Так, например, изомасляная кислота кипит на 9,2°С ниже, чем масляная:
изовалериановая на 9,6°С ниже, чем валериановая, а триметилуксусная - даже на 22,6°С ниже, чем изомерная ей валериановая кислота:
Ароматические карбоновые кислоты имеют высокие температуры кипения и плавления. Например:
1.3 Растворимость карбоновых кислот Три первые предельные монокарбоновые кислоты смешиваются с водой, этанолом и диметиловым эфиром во всех отношениях. Начиная с С4, растворимость в воде становится ограниченной и быстро падает с ростом углеродной цепи, что видно из данных таблицы:
Поиск по сайту: |
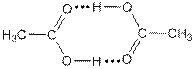
 Температуры кипения у карбоновых кислот высокие, так как они дают димеры за счёт возникновения двух водородных связей:
Температуры кипения у карбоновых кислот высокие, так как они дают димеры за счёт возникновения двух водородных связей: