|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тема 16. Біосинтез амінокислот
16.1 Основні закономірності біосинтезу амінокислот
В останні роки широке застосування в народному господарстві, медицині і сільському господарстві знаходять різноманітні амінокислоти. Особливе значення вони мають для покриття дефіциту в азотному живленні. Деякі харчові і кормові продукти не містять у своєму складі необхідну кількість незамінних амінокислот, зокрема лізину. До таких продуктів відносяться широко розповсюдженні пшениця, кукурудза, овес, рис і ряд інших. Для ліквідації можливого дисбалансу амінокислоти використовують в чистому вигляді або вводять до складу преміксів. Тому основною сферою застосування амінокислот слід вважати створення раціонів, що дозволяють знизити вміст рослинних білків у кормах. Світовий рівень виробництва амінокислот сягає на даний час декілька мільйонів тон на рік. Провідне місце займає мікробіологічний синтез. Мікробіологічний синтез амінокислот сьогодні є перспективним і економічно доцільним способом виробництва. У процесі ферментації безпосередньо синтезуються L-амінокислоти. Крім мікробіологічного синтезу амінокислоти можна отримувати шляхом гідролізу природного білок-місткої тваринної і рослинної сировини і хімічним синтезом. Перший з названих способів є найбільш старим. Наприклад, у країнах Південно-Східної Азії моноглутамат натрію отримують із соєвого шроту (знежиреної соєвої муки). Описані способи отримання амінокислот із клейковини пшениці і кукурудзяного глютену, що залишається після відмивання крохмалю. У рівній мірі можуть бути названі і інші білки, але їх використання для отримання амінокислот економічно не доцільне. Хімічний синтез амінокислот достатньо ефективний, але його недоліком є отримання готових продуктів у вигляді рацематів. На даний момент ще не знайдені достатньо ефективні і дешеві шляхи розділення амінокислот на оптичні ізомери. У зв’язку з цим хімічний синтез залишається рентабельним для отримання тих амінокислот, які можуть бути використані у виглядів рацематів. В останні роки починає займати міцні позиції комбінований хіміко-мікробіологічний метод синтезу, при якому вихідну сполуку отримують в результаті хімічних реакцій, а кінцева стадія здійснюється за рахунок активності ензиматичних систем, що відповідають штамам мікроорганізмів. Серед амінокислот, що отримують методом мікробіологічного синтезу, найбільшу питому вагу має лізин. Метіонін отримують переважно шляхом хімічного синтезу. Глютамінова кислота, що займає видне місце у світовому виробництві, використовується в основному у вигляді мононатрієвої солі для покращення смаку харчових продуктів. До числа дефіцитних амінокислот відноситься триптофан. Однак питання про ліквідацію його дефіциту може бути вирішене шляхом регуляції обміну речовин через нікотинову кислоту. Здатність акумулювати у середовищі для культивування амінокислот виявлена у багатьох мікроорганізмів. Відносяться вони до різних таксономічних груп. Серед культур, що є потенціальними продуцентами глютамінової кислоти, виявлено 20% бактерій (із 650 досліджених), 30% стрептоміцетів (із 372), 30% дріжджів (із 468) і 10% мікроскопічних грибів (із 475). Як правило, більшість культур, що досліджено незалежно від їх систематичного положення переважно накопичують α-аланін і глютамінову кислоту і значно менше і у меншого числа штамів міститься аспарагінова кислота, лейцин, валін, ізолейцин, лізин. Строгої кореляції між видовою приналежністю організму і його здатністю накопичувати амінокислоти немає. Не дивлячись на широке розповсюдження культур, що накопичують амінокислоти, продуцентів, що забезпечують економічно доцільні виходи, не так багато. Отримують їх звичайним шляхом застосування різноманітних мутагенних факторів. Продуцент повинен акумулювати переважно одну амінокислоту. Одночасна присутність декількох амінокислот, особливо якщо вони близькі за фізико-хімічними властивостями, утрудняє їх виділення і очистку. Ауксотрофні мутанти, що позбавлені ряду ензиматичних систем в результаті дії мутагенів, є найбільш цінними продуцентами. Блокада відповідних реакцій в ланцюгу обміну речовин призводить у таких мутантів до надсинтезу одного із метаболітів. Найбільш розповсюдженими продуцентами є бактеріальні культури, що відносяться до родів Brevibacterium, Micrococcus, Microbacterium, Corynebacterium, Arthrobacter. Всі вони грампозитивні, паличкоподібні, не утворюють спор. Амінокислоти накопичуються в середовищі. Вони не є продуктами ферментативного розпаду білків середовища. Ферментативні реакції синтезу протікають в середині клітин. Спочатку амінокислоти накопичуються в середині клітин у вигляді вільних амінокислот. На ранніх етапах росту культури вони включаються в конструктивний обмін. Активне накопичення амінокислот в середовищі відбувається з середини експоненційної фази росту культури, досягаючи максимуму до її кінця.
16.2 Глютамінова кислота
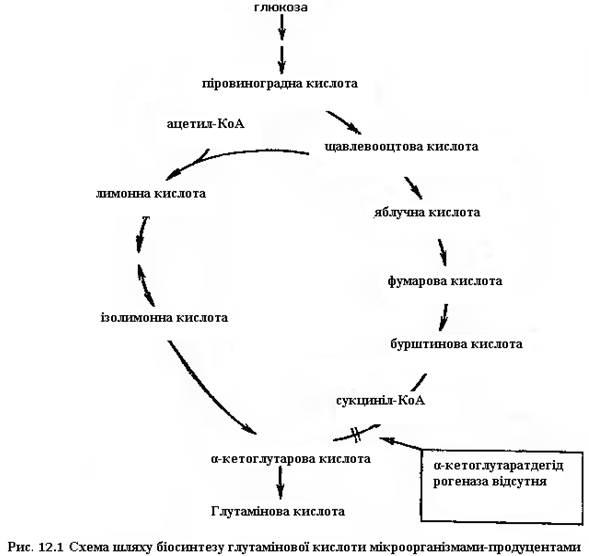
При біосинтезі глутамінової кислоти безпосереднім метаболічним попередником є α-кетоглутарова кислота, яка виникає завдяки функціонування в клітинах циклу Кребса. Синтез глютамінової кислоти відбувається в результаті ферментативного відновного амінування α-кетоглутарової кислоти за рахунок НАД- чи НАДФ-залежної глутаматдегідрогенази:
α-кетоглутарова кислота може також вступати в реакцію переамінування з амінокислотами, що здійснюється трансаміназами. Коферментом в реакції переамінування слугує піридоксаль-5’-фосфат:
В циклі Кребса α-кетоглутарова кислота утворюється з ізолимонної кислоти під дією ферменту ізоцитратдегідрогенази. Згідно приведеній нижче схемі, один і той самий коензим НАДФ специфічний для двох дегідрогеназ: ізоцитратдегідрогенази і глютаматдегідрогенази. Таким чином, необхідний для синтеза глютамінової кислоти коензим постійно регенерується при окисленні ізолимонної кислоти в α-кетоглутарову.
Аналіз ферментних систем циклу Кребса у штаму, що продукує глутамінову кислоту показав, що в культурі є всі ферменти, крім α-кетоглутаратдегідрогенази, що перетворює α-кетоглутарову кислоту в сукциніл-КоА (рис. 16.1). Не менш важливим фактором є понижена активність НАДФН2-термінальної оксидазної системи, яка окислює глутамінову кислоту, що дозволяє майже кількісно зберегти синтезований продукт. Для деяких культур, що продукують глутамінову кислоту, наприклад Brevibacterium flavum, показано, що при функціонуванні циклу Кребса відбувається пригнічення ферментативної активності його власними метаболітами. Зокрема, цис-аконітова кислота пригнічує активність цитратсинтетази, α-кетоглутарова – ізоцитратдегідрогенази. При цьому функція гліоксилатного шляху не порушується, на активність ізоцитратліази метаболіти циклу Кребса, мабуть, не впливають. Одним із перших методів мікробіологічного синтезу глутамінової кислоти була ензиматична трансформація α-кетоглутарової кислоти за рахунок високої глутаматдегідрогеназної активності деяких культур. При цьому в реакційну систему вводили сіль амонію, α-кетоглутарову кислоту і її сіль, буфер, що забезпечує оптимум ензиматичної реакції, і суспензію культури, що несе глутаматдегідрогеназну активність.
Цей метод не отримав розвитку і був витіснений більш вигідною економічно ферментацією. Однією із суттєвих причин, що змусили відмовитися від метода трансформації, слугувало швидке зникнення зі сфери реакції кофермента, відновлення якого можливе за рахунок функціонування відповідних НАД-залежних зв’язаних систем, зокрема циклу Кребса. Одночасне внесення цього коферменту в систему трансформації занадто дороге.
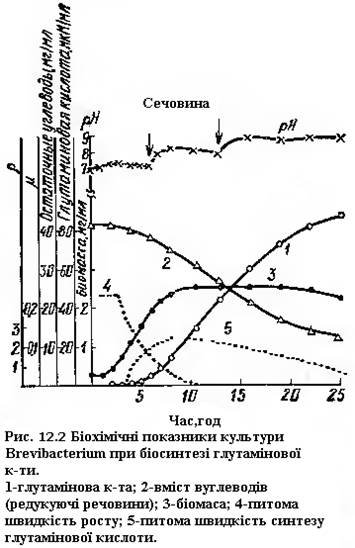
При ферментації глутамінової кислоти в якості джерела вуглеводу можна вводити глюкозу, крохмаль; із технічних продуктів – мелясу, гідрол. В останні роки в якості вуглецевого компоненту середовища почали використовувати вуглеводні, етанол, метанол, оцтову кислоту; із джерел азоту – солі амонію або сечовину. Концентрація вуглеводів в середовищах при отриманні глютамінової кислоти звичайно достатньо висока, до 5 – 10%. Вихідна концентрація джерел азоту низька. При такому співвідношенні азоту і вуглецю в середовищі неминуче закислення і зниження рН. Разом з тим таке співвідношення веде до обмеженого росту біомаси, але, з іншої сторони, до накопичення метаболічного попередника глутамінової кислоти - α-кетоглутарової кислоти. Щоб включити в реакцію синтезу α-кетоглутарову кислоту, в середовище періодично вводять розчин сечовини. Остання, розкладаючись уреазою продуцента, утворює аміак, який вступає в реакцію з α-кетоглутаровою кислотою, утворюючи глутамінову кислоту. Введення розчину сечовини здійснюється автоматично, коли рівень рН в середовищі досягає деякої контрольної величини (рис. 16.2). Як бачимо з рисунка, накопичення глутамінової кислоти відбувається тільки тоді, коли ріст культури завершений. Деякі продуценти глутамінової кислоти, наприклад Corynebacterium glutamicum, здатні при зміненні умов культивування накопичувати у середовищі L-глутамін. Фактично, напевно, мова іде про початковий синтез глутамінової кислоти і подальше утворення аміду. Реакція протікає за участі глутамінсинтетази.
16.3 Лізин
Мікробіологічний синтез. Здійснюють мутантні штами, що відносяться до родів Micrococcus і Brevibacterium. Як правило, вони проявляють дефіцит до однієї з амінокислот: гомосерину, треоніну, ізолейцину, метіоніну або їх поєднання, а також до біотину і тіаміну. На рис. 12.3 дана схема біосинтезу лізину, на якій показані продукти, що синтезуються за спільним з лізином шляхом – з аспарагінової кислоти, а на рис. 12.4 деталізований шлях від напівальдегіда аспарагінової кислоти. Крім цього шляху еукаріотні організми мають ще один шлях синтезу лізину через α-аміноадипінову кислоту (рис. 12.5). У відповідності зі схемою для біосинтезу лізину і його накопичення необхідно створити такі умови, при яких буде обмежений синтез аланіну, глутамінової і молочної кислот, але інтенсифікований синтез аспарагінової кислоти. В основі біохімічного механізму регуляції синтезу лізину лежить принцип негативного зворотного зв’язку. Згідно цьому принципу, надлишок кінцевого продукту реакції інгібує свій власний синтез. В одному випадку пригнічується активність одного чи ряду ферментів, відбувається ретроінгібування, що пов’язане з алостеричним ефектом, в другому – припиняється синтез самого ферменту, має місце репресія. Звідсіля видно, що ряд амінокислот в середовищі повинен бути присутнім у строго визначеній кількості, достатній тільки для росту культури. Вузловим ферментом у синтезі лізину є аспартаткіназа. Пригнічують її лізин і треонін при їх спільній дії, оскільки аспартаткіназа представляє собою мультивалентний фермент. Треонін інгібує у Micrococcus glutamicus дегідрогеназу напівальдегіду аспарагінової кислоти і гомосерин-дегідрогеназу. Метіонін по відношенню до гомосериндегідрогенази є репресором. Ізолейцин інгібує треоніндегідрогеназу.
Приведені дані показують, що продукти обміну речовин, які пригнічують різноманітні ферменти, які приймають участь в синтезі лізину, повинні бути виведені із сфери реакції. Саме тому дефіцитні штами є найбільш зручними для виробництва. Так, культура, що позбавлена активності гомосериндегідрогенази, забезпечує достатньо високі виходи лізину. Дефіцитні амінокислоти, які необхідні для росту, вносять із середовищем. Вони звичайно містяться в природних продуктах, наприклад в мелясі. Але кількість цих амінокислот повинна контролюватися, щоб не були створені умови, при яких амінокислоти виступлять в якості регуляторів процесу. Одним із компонентів середовища, що впливає на хід біосинтезу, є фосфор у вигляді фосфат-іону. При збільшені оптимальної, для накопичення лізину, концентрації фосфору в 10 разів кількість лізину знижувалася на 40%, а вміст інших амінокислот, особливо валіну, значно збільшувався. При вивченні механізмів регуляції синтезу цільових продуктів особливу увагу звертають на кінцеві етапи біосинтезу, як це було показано вище на прикладі лізину. Разом з тим дуже важливо знати весь шлях біосинтезу з точки зору оцінки ензиматичної активності усіх реально функціонуючих ферментних систем. Зокрема, суттєвий інтерес може представити співвідношення кількості глюкози, що включається в обмін речовини по шляху гліколізу або через гексозомонофосфатний шлях. Відносно до механізму синтезу лізину безперечний інтерес представляє функція циклу Кребса. Відомо, що шлях синтезу лізину проходить через цикл Кребса, далі – через аспарагінову кислоту після амінування щавлевооцтової і її фосфорильованої похідної. Існує уявлення про вплив концентрації джерела вуглеводу на синтез лізину. Показано, що при збільшенні концентрації вуглеводів в середовищі вище деякої оптимальної, емпірично встановленої величини подовжується лаг-фаза, в логарифмічній фазі збільшується питома швидкість росту, але понижується вихід лізину і змінюється активність ферментів гліколізу і циклу Кребса. Слід відмітити, що оптимальна для синтезу лізину концентрація не є постійною величиною. Вона залежить від багатьох показників, і зокрема від інтенсивності перемішування середовища. Максимальна лізинсинтезуюча активність продуцента Brevibacterium sp.22 звичайно спостерігається при високих значеннях активності ферментів циклу Кребса. Максимальна питома швидкість росту має місце при порівняно низьких величинах активності ферментів циклу Кребса, але високих рівнях активності ферментів гліколізу і гсекозомонофосфатного шляху асиміляції вуглеводів.
При переключенні від інтенсивного росту до умов, що сприятливі для синтезу лізину, тобто при переході до уповільненого росту одночасно спостерігається підвищення рівня активності ферментів циклу Кребса. На величину активності ферментів гліколізу і циклу Кребса впливають не тільки концентрації вуглеводів, але й швидкість, з якою вони потрапляють в клітину продуцента.
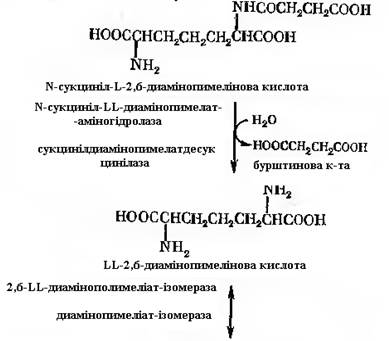
Ензиматичні методи. Одним із способів отримання лізину є ензиматичний метод, де в якості субстрату служить мезо-ізомер α-ε-диамінопимелінової кислоти, в якості ферменту – диамінопимелінат-декарбоксилаза. Практично використовують суспензію мікробних клітин (зокрема, продуценти лізину Brevibacterium 22), заздалегідь вирощених на відповідному середовищі. Іноді мікробні клітини заздалегідь оброблюють ацетоном, отримуючи «ацетоновий порошок». Однак його застосування не завжди можливе, особливо в тих випадках, коли α-ε-диамінопимелінова кислота не здатна проникати в клітини мікроорганізму, де протікає реакція декарбоксилювання. В такому випадку рекомендується проводити дезінтеграцію клітин в умовах, що виключають інактивацію ферменту. Декарбоксилаза культури Brevibacterium 22 представляє собою алостеричний фермент з декількома активними центрами. Для проявлення ферментативної активності необхідний піридоксальфосфат. Культура сама його синтезує. Перед тим як пройде реакція декарбоксилювання, субстрат повинен бути переведений у мезо-форму. В умовах ферментації культура сама переводить його в мезо-форму із LL-ізомеру за рахунок активності диамінопимелінатепімерази.
Запропоновано декілька технічних способів переводу в мезо-форму, наприклад теплова обробка при 200˚С, пропускання через сульфокатіон в Н-формі і т.д. Розроблені методи культивування Brevibacterium 22, що забезпечують високу декарбоксилазну активність. Закономірності, що спостерігаються при вирощуванні культури, показані на рис. 12-6. Найбільша питома активність ферменту на напівсинтетичному середовищі спостерігалася на 18-20 годину росту, тобто в кінці логарифмічної фази росту; на мелясному середовищі – в середині логарифмічної фази росту. Окрім використання α-ε-диамінопимелінової кислоти в якості субстрату ферментативного декарбоксилювання при отриманні лізину показана можливість ферментативної конверсії в лізин DL-α-аміно-ε-капролактаму. Для здійснення процесу спочатку шляхом хімічних реакцій із циклогексану отримують DL-α-аміно-ε-капролактам, який на стадії ферментативного гідролізу перетворюється в L-лізин. При цьому відбувається розділення оптичних ізомерів, які є найбільш складним і дорогим процесом при хімічному синтезі всіх L-амінокислот. Цей метод припускає участь двох ензиматичних реакцій: рацемізацію D-α-аміно-ε-капролактама і гідроліз L-амінолактаму (рис. 12-7).
Продуцентами гідролази L-α-аміно-ε-капролактаму слугують деякі штами дріжджів, що відносяться до сімейства Cryptococcus, Candida, Trichosporon. Культивування ведеться в аеробних умовах при температурі 20 – 40˚С, рН 6 – 10 на середовищі, що містить глюкозу, сіль амонію, фосфати, солі магнію і марганцю. Неодмінно повинен бути присутній DL-α-аміно-ε-капролактам (або L-ізомер). Джерелом ферменту для здійснення технологічного процесу гідролізу може слугувати біомаса клітин, що узяті відразу після культивування, клітини, оброблені ацетоном; клітини після сублімаційної сушки; клітинний екстракт і очищений фермент L-α-аміно-ε-капролактамгідролаза. Реакція проходить в лужній зоні рН, при температурі 40 - 50˚С. При більш високій температурі активність падає. Активаторами ферменту є іони Mn, Mg, Zn. Після закінчення реакції отриманий лізин достають з реакційної суміші яким-небудь відомим способом. D-α-аміно-ε-капролактам піддається рацемізації.
Рацемазу отримують при культивуванні бактерій, що відносяться до сімейства Achromobacter, Flavobacterium та ін. Продуценти вирощують при температурі 32˚С протягом доби і рН середовища 7,3. Неодмінним компонентом середовища, як і в попередньому випадку, є DL-α-аміно-ε-капролактам або його хлоргідрат. Принцип дії ферменту, мабуть, однаковий з таким рацемаз амінокислот, що потребують в якості кофактору піридоксаль-5-фосфат. При отриманні L-лізину доцільна спільна дія двох ферментів на субстрат. Для цього у водний розчин DL-α-аміно-ε-капролактаму вводять необхідну кількість дріжджових і бактеріальних клітин, що несуть гідролізну і рацемазну активності. Для спільної дії двох ферментів найбільш сприятливим є рН середовища 8,0 – 8,5, температура 30 – 50˚С. В результаті реакції DL-α-аміно-ε-капролактам кількісно переходить в L-лізин. Викладений спосіб отримання L-лізину цікавий тим, що обидва ферменти можна отримати в іммобілізованій формі. Окрім чистого лізину і його хлористоводневої солі промисловість випускає так званий кормовий лізин. Останній представляє собою порошок, отриманий шляхом сушки культуральної рідини продуценту лізину в розпилювальній сушарці. У порошку містить лізин, продукти метаболізму продуценту і його клітини. Для підвищення кормової цінності препарату в ферментер, де відбувається біосинтез лізину, запропоновано додавати культуру кормових дріжджів. Вони асимілюють компоненти середовища, які не використовують продуцент, швидко розмножуються і тим самим вносять в препарат деякеу додаткову кількість білку.
16.4 Триптофан
Триптофан відноситься до числа незамінних амінокислот, дефіцит якого відчувається в багатьох харчових і кормових продуктах. Технологічний процес його отримання методом мікробіологічного синтезу більш складний, ніж виробництво глутамінової кислоти і лізину, а вихід готового продукту значно нижче. Ключові позиції біосинтезу триптофану закладені в гексозомонофосфатному шляху асиміляції вуглеводів. Відомо, що одним із продуктів цього шляху є шикимова кислота, що дає в результаті ряду ензиматичних перетворень хоризмову кислоту. Остання може за рахунок хоризматмутази давати префенову кислоту або антранілову, якщо каталіз веде антранілсинтетаза. Антранілова кислота слугує метаболічним попередником при синтезі триптофану (рис. 12-8). Основним етапом цього шляху слід вважати формування пірольного гетероциклу і приєднання бокового ланцюга до індольного ядра. Оскільки блокада хоризматмутази, що веде до утворення префенової кислоти, багата наслідками порушення в метаболізмі продуценту, краще для багатьох продуцентів вводити в склад середовища антранілову кислоту. Остання відносно не дорога і легко синтезується хімічним шляхом із фталевого ангідриду. Індольні сполуки, які теж можна було б розглядати як метаболічні попередники, менш стійкі. Здійснення процесу ферментації без додавання антранілової кислоти украй скрутно внаслідок інгібуючого ефекту триптофану на антранілатсинтетазу. При культивуванні продуцентів триптофану використовують різноманітні, широко розповсюдженні в мікробіологічній промисловості середовища, що містять мелясу, сечовину та інші компоненти. В залежності від технології часто їх вносять в середовища дробово по ходу ферментації. Обов’язковою умовою процесу є дробове введення антранілової кислоти. Необхідно мати на увазі, що багато мікроорганізмів не мають системи транспорту антранілової кислоти із середовища в клітину, так як вона є типовим продуктом внутрішньоклітинного метаболізму.
16.5 Ензиматичний спосіб отримання оптичних ізомерів
Одним із способів розділення рацематів амінокислот на L- і D-ізомери є ензиматичний шлях з використанням мікроорганізмів, що володіють специфічною L-ацилазною активністю. Ацилази розривають пептидний зв'язок у ацилпохідних амінокислот або пептидів, в результаті утворюються відповідні вільні амінокислоти і пептиди, а також органічна кислота (вертикальний пунктир показує місце дії ацилази):
При культивуванні мікроорганізмів, що містять ацилази, необхідно дотримуватися ряду умов, зокрема вводити в середовища індуктори. Як правило, ними є речовини, що близькі за природою до субстрату дії ацилаз, наприклад у випадку роботи з лізином ε-ацетил- L-лізин. Ацилази грибів і дріжджів знаходяться всередині клітин, тому їх необхідно заздалегідь піддавати дезінтеграції, можливо, із застосуванням ультразвуку. Основою для використання мікробних ацилаз для гідролізу ацилпохідних амінокислот є специфічність їх дії відносно оптичної конфігурації і структури субстрату. У відповідності з характером асиметричного деацилювання субстрату розрізняють L- і D-ацилази, при чому у мікроорганізмів найбільш часто виявляються L-ацилази. В залежності від характеру ацильного радикалу, що відщеплюється розрізняють, зокрема, ацетил-, бензоїл-, хлорацетил- та інші похідні амінокислот. Оскільки найбільш розповсюдженими є ацетил- і бензоїлацилази, саме такі похідні амінокислот переважно використовують в реакціях. Необхідно мати на увазі специфічність ацилази до амінокислотного залишку. Вказані особливості ацилаз дозволяють використовувати їх для виділення потрібної амінокислоти із суміші багатьох ацилпохідних:
Ацил-рацемат, що залишається і ацил- D-амінокислота легко відділяють від оптично активної амінокислоти в наслідок відмінностей в їх фізико-хімічних властивостях, наприклад розчинності в органічних розчинниках і у воді, здатності сорбуватися на іонітах. Використання D-ізомерів теоретично можливе, якщо мати на увазі подальше застосування рацемаз (ферментів класу ізомераз) або хімічних способів. Наприклад, деякі N-ацетил-D-амінокислоти можуть легко перетво-рюватися в N-ацетил-D-амінокислоти шляхом нагрівання в присутності оцтового ангідриду. Процес рацемізації може бути реалізованим з високим виходом шляхом застосування іммобілізованих ферментів. 16.6 Компоненти середовища, що регулюють мікробіологічний синтез
При мікробіологічному синтезі амінокислот широке розповсюдження в якості компонентів середовищ для культивування мають поверхнево-активні речовини, біотин і деякі антибіотики. Біотин містить багато рослинних продуктів, які часто входять до складу ферментаційних середовищ. Найбільш багата біотином меляса, що є одним із основним інгредієнтів середовищ. Надлишок біотину негативно позначається на накопиченні глутамінової кислоти. Кількість його в середовищі повинно бути мінімальним. Наприклад, при 10% концентрації глюкози оптимальний вміст біотину на 1 л середовища повинен бути в межах 2 – 4 мкг. Оптимум концентрації біотину в відомих межах знаходиться в залежності від вмісту глюкози. Кількість біотину, необхідного для максимального накопичення глутамінової кислоти, завжди менше тієї концентрації, яка потрібна для максимального росту даної культури. При отриманні лізину і α-аланіну оптимальні концентрації біотину в середовищі звичайно в 5 – 10 раз вище, ніж при отриманні глутамінової кислоти. Біотин в ряді випадків виявлявся фактором, що регулює процес біосинтезу: одна й та ж сама культура при низьких концентраціях біотину накопичувала глютамінову кислоту, при високих – лізин. Функція біотину в цьому процесі отримала відповідну оцінку при вивченні метаболічного фонду клітин продуцентів амінокислот. Як було сказано вище, амінокислоти спочатку накопичуються в клітині, складаючи амінокислотний пул, або фонд. Було відмічено, що амінокислотний пул клітин Brevibacterium flavum, що виросли на бідному біотином середовищі, нижче, ніж у тих, що виросли на збагаченому ним. Цей факт пов’язують з підвищеною проникністю клітинних стінок культур, що виросли на бідному біотином середовищі.
Дослідження ліпідного складу мембран клітин, бідних і багатих біотином, показало, що мембрана «бідних» клітин, які здатні накопичувати глутамінову кислоту, містила більше насичених жирних кислот, ніж ненасичених, в протилежність «багатим» клітинам. Крім того, в мембрані клітин, бідних біотином, менше фосфоліпідів, ніж в мембрані багатих біотином. Таким чином, одна із функцій біотину зводиться до синтезу ненасичених жирних кислот, які знижають проникність мембрани для глутамінової кислоти. Надлишок біотину в середовищі може призвести до підвищення активності α-кетоглутаратдегідрогенази, тобто направити протікання реакції у бік синтезу сукциніл-КоА (рис. 12.9). В цьому випадку знижується вихід глютамінової кислоти. Дослідження були проведені з культурою Brevibacterium, яка не має блоку по α-кетоглутаратдегідрогеназі. Механізм дії біотину тут не ясний, так як він не бере участі в каталітичному акті, що здійснюється α-кетоглутаратдегідрогеназною системою. З метою підвищення проникності клітинних стінок рекомендують вводити в середовища деякі антибіотики, зокрема калієву сіль бензилпеніциліну. Збільшення проникності відбувається, напевно, внаслідок порушення структури пептидогліканового шару клітинної стінки. Відомо, що пеніцилін порушує утворення «містків» в пептидній частині структури. Підвищення проникності клітинної стінки неможливе також при введенні в середовища поверхнево-активних речовин. Деякі із детергентів, що добіляють до бактеріальних суспензій, визивають інтенсивний «витік» із клітин амінокислот, нуклеотидів та інших низькомолекулярних метаболітів. Вивчення механізму взаємодії іонних детергентів з клітинними структурами показало, що поверхнево-активні речовини зиіонного типу взаємодіють, певно, кетоамідними групами мембранних білків і аміногрупами в аміно полісахаридах, речовини катіонного типу – з карбоксильними групами білку. Із найбільш відомих агентів, що впливають на проникність клітин і вихід глутамінової кислоти, слід назвати твін-40 (поліоксиетилен сорбітан монопальмітат), твин-60 (поліоксиетилен сорбітан стеарат), поліетиленгліколь, N-міристоїлгліцин. Рекомендується спільне застосування пеніциліну з поверхнево-активними речовинами.
Контрольні питання: 1. Навести закономірності біосинтезу амінокислот 2. Охарактеризувати особливості біосинтезу глютамінової кислоти 3. Охарактеризувати особливості біосинтезу лізину 4. Охарактеризувати особливості біосинтезу триптофану 5. Розкрити особливості одержання оптичних ізомерів 6. Охарактеризувати особливості регуляції біосинтезу амінокислот
Поиск по сайту: |



 Слабокисла зона рН, невисокої концентрації біотину і відносно висока у порівнянні з ферментацією глутамінової кислоти концентрація хлориду амонію, а також присутність іонів Zn сприяло практично повному припиненню глутамінової кислоти в глутамін по ходу ферментації.
Слабокисла зона рН, невисокої концентрації біотину і відносно висока у порівнянні з ферментацією глутамінової кислоти концентрація хлориду амонію, а також присутність іонів Zn сприяло практично повному припиненню глутамінової кислоти в глутамін по ходу ферментації.