|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тема 9. Асиміляція вуглеводнів, етанолу, метанолу й ацетату мікроорганізмами
9.1 Асиміляція вуглеводнів
В останні роки в ряді економічно розвинених країн світу виникла нова галузь мікробіологічної промисловості, основне призначення якої - одержувати додаткові кормові продукти, насичені білком і вітамінами. З мікроорганізмів, як правило, найбільше часто використають дріжджі, а основним вуглець містким компонентом середовища є вуглеводні, переважно н-алкани. Асиміляція вуглеводнів має свої специфічні особливості не тільки по механізму окислювання н-алканів, але й по механізму транспорту, а також локалізації в клітині. Очевидно, дріжджові клітини, що відносяться до родів Candіda Torulopsіs, не мають спеціальних пермеазних систем, що здійснюють транспорт н-алканів із середовища в клітину. Проте клітина не байдужа до присутності н-алканів у середовищі. Дріжджові клітини, вирощені на них, мають деякі морфологічні відмінності від клітин, вирощених на глюкозі. Крім транспорту, здійснюваного через канали в стінках, передбачається можливість надходження вуглеводнів у клітину дріжджів так названим молекулярно-дифузним шляхом. Відповідно до цієї теорії існує два етапи в поглинанні вуглеводнів. Первинний етап представляє собою пасивне, фізико-хімічне сорбційне поглинання й дифузійне пересування через всю клітинну оболонку до цитоплазматичної мембрани тільки через зовнішній шар клітинної оболонки. Другий етап - активне поглинання - обумовлене протіканням метаболічних реакцій, які зрушують сорбційну рівновагу й створюють відповідний сорбційний градієнт, що забезпечує безперервність надходження вуглеводню в клітини. Найбільше детально вивчена ферментна система окислювання вуглеводнів в аеробних умовах у бактеріальних культур, що відносяться до Pseudomonas. Вона містить три білкові фракції, які становлять ланцюг переносу електронів, що нагадує дихальний ланцюг у системі окисного фосфорилювання. В якості донорів водню, що служать джерелами електронів, тут виступають НАД-Н. (можливо НАДФ-Н). Найпершим у ланцюзі компонентів являє собою фермент НАД-Н-рубредоксин-оксидоредуктаза (рубредоксин-над+-редуктаза), що відноситься до флавопротеїнів. Фермент відновлює окислений рубредоксин:
Рубредоксин являє собою низькомолекулярний залізовмісний білок У його. склад входять 1-2 атома заліза, пов'язаних із вхідними в молекулу залишками цистеїну. Окислювально-відновні реакції можуть здійснюватися внаслідок змінної валентності заліза. По своїх властивостях рубредоксин нагадує білок фередоксин з фотосинтезуючих організмів. Заключний етап здійснює фермент ω-гідроксилаза. Названо фермент так внаслідок своєї здатності гідроксилювати н-карбонові кислоти, отримані з жирів. Гідроксилаза приймає електрон від рубредоксину, передаючи його на субстрат:
9.2 Включення етанолу й ацетату в обмін речовин
Деякі технологічні труднощі, що виникають при культивуванні мікроорганізмів на н-алканах, привели до необхідності використовувати етанол в якості сировини. Ці роботи привели до того, що були знайдені культури, що добре ростуть на етанолі або оцтовій кислоті. Виявилося можливим одержувати не тільки біомасу, але і деякі продукти ферментації, наприклад амінокислоти. Ацетат входить у середовища переважно у вигляді солі амонію. Початкові концентрації звичайно не перевищують 1- 2 %, однак по ходу культивування проводиться дробова добавка ацетату. Етанол також вводять у середовища в невисоких концентраціях і потім роблять дробові добавки. Як видно з наведеної нижче схеми, з етанолу утвориться ацетальдегід.
У ході реакцій окислювання етанолу утворяться дві молекули відновленої форми НАД, які можуть включатися в реакції синтезу.
9.3 Асиміляція метанолу
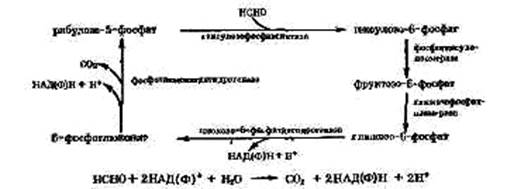
Крім оцтової кислоти й етанолу в якості можливого потенційного компонента середовища називають метанол. Перший етап включення метанолу в обмін речовин - утворення формальдегіду за рахунок метанолдегідрогенази - механізм її дії у деталях невідомий.
Відповідно до однієї з теорій, птеридиновий кофактор функціонує як акцептор електронів. Друга теорія припускає, що метильна група метанолу може зв'язуватися з N-атомом птеридинового кільця й окислятися до N 5,10-метиленового похідного птеридина при додаванні акцептора електронів. Можливо також, що метанол зв’язується з дигідроформою птеридина, утворюючі 5-мегилгідропохідні. У результаті наступних внутрішньо-молекулярних перебудов утворюється N 5,10-метилденітропохідні птеридина, що може потім реокислятися в дигідропохідні в присутності акцептора електронів. Отже, птеридин може діяти як аналог ФАД або ФМН у флавопротеїдних ферментах або становити частину молекули, подібної до фолевої кислоті, виступаючи в ролі переносника й акцептора електронів. Продукт окислювання метанолу - формальдегід надходить далі в біосинтетичні шляхи або окисляється до мурашиної кислоти. Відомі деякі ферменти, здатні окисляти формальдегід до форміату. Крім того, є циклічний шлях окислювання формальдегіду. Асимілювати метанол можуть не тільки бактерії, але й дріжджові культури.
Контрольні питання: 1. Охарактеризувати особливості засвоювання вуглеводнів мікроорганізмами 2. Розкрити особливості включення етанолу й ацетату в обмін речовин 3. Охарактеризувати особливості засвоювання метанолу мікроорганізмами Тема 10. Основні принципи регуляції обміну речовин у мікроорганізмів. 10.1 Основні уявлення про механізм регуляції
У мікробних клітинах функціонують різні системи регуляції обміну речовин. Принципові розходження між ними полягають у наступному: за допомогою однієї з них відбувається регуляція синтезу ферментів, за допомогою іншої - регуляція їх активності. Посередниками в здійсненні цих механізмів є низькомолекулярні з'єднання, які або синтезуються клітиною, або надходять у клітину з навколишнього середовища. Основні дані про механізми регуляція були отримані на мутантних штамах або в досвідах іn vіtro на моделях. Останні не завжди в стані відтворити умови, близькі до іn vіvo, наприклад, у більшості лабораторних досліджень використовують розведені водяні розчини ферментів. У таких дослідженнях звичайно молярність субстрату в мільйон раз вище, ніж у ферменту, тоді як стає усе більше очевидним, що концентрації ферментів, субстратів і молекул-регуляторів близькі для більшості метаболічних шляхів. Модельні системи також майже не ураховують фазовий стан системи, зміни кінетичних характеристик в умовах, що нагадує гелі, вплив концентраційних ефектів. Тому деякі наші подання, отримані в досвідах іn vіtro, не завжди можуть бути перенесені на живі організми. Істотний вплив на метаболізм, як позитивне, так і негативне, можуть робити слабкі білок-білкові взаємодії. Для ферментів гліколізу, зокрема, можливо існування комплексу, що зазвичай, позитивно впливає на функції системи. З іншого боку, реальна величина ферментативної активності в клітині може бути значно меншою, чим ніж дані, отримані іn vіtro. Відбувається це від тенденції багатьох внутрішньоклітинних ферментів до зв'язування з окремими клітинними структурами.
10.2 Індукція й репресія синтезу ферментних білків
Інформація про синтез ферментів, так само як й інших білків записана в геномі. Прийнято вважати, що клітина має два типи ферментів, що розрізняються по механізму регуляції їх синтезу: конститутивні й індуцибельні. Індуцибельні ферменти синтезуються клітиною у відповідь на вплив певного фактора зовнішнього середовища. Такими факторами зовнішнього середовища, як правило, буває який-небудь компонент середовища для культивування або середовища перебування. Наявність такої речовини в середовищі приводить до значного прискорення синтезу ферментів, відповідальних за його розщеплення й утилізацію. Така індукція відбувається в результаті посилення матричної активності відповідних генів, тобто, активування процесу. Безпосередній акт індукції синтезу ферментів у клітині відбувається під дією некаталітичних алостеричних білків, які є продуктами певних регуляторних генів. Білки контролюють синтез ферментів негативно, тобто зв'язуються з бактеріальною хромосомою на якійсь ділянці поблизу структурних генів, що детермінують синтез цих ферментів, і перешкоджають їхній транскрипції. У відповідності зі сказаним вище не виникає, очевидно, труднощів у взаємодії внутрішньоклітинних субстратів катаболізму з регуляторною системою клітини прокаріотних організмів. Інакше стоїть справа з індукторами, що перебувають поза клітиною. Щоб індуктор проникнув у клітину, необхідно мати відповідну транспортну (пермеазну) систему. Відомо, що транспорт високомолекулярних поживних речовин у клітину із середовища обмежений, звичайно попередньо відбувається їхній ферментативний гідроліз. Ферменти, що здійснюють гідроліз, також здебільшого індуцибельні, тобто вимагають індуктора. У більшості випадків індуктори невідомі. Сигнал, що є присутнім поза клітиною, або повинен бути ензиматичним трансформований, щоб стати внутрішньоклітинним індуктором, або він є тільки першою ланкою сигналу, що викликає наростання або падіння концентрації індукторів у клітині. Під індуктором і репресором (разом позначаються як ефектор) варто розуміти речовини, які приводять до зміни швидкості синтезу білків при додаванні їх до культури (фізіологічні сигнали) При цьому, можливо, є регуляторним апаратом взаємодіє не сама додана речовина, а його метаболіт або навіть речовина іншого походження, концентрація якої підвищується в присутності доданої в середовище речовини. У більшості випадків як індуктори використовують субстрат дії ферменту. У цей час система регуляції синтезу індуцибельних ферментів детально вивчена на прикладі β-галактозидази Е. colі. Сьогодні очевидно, що дана система у всіх деталях може розглядатися тільки для прокаріотних мікроорганізмів. Гени, що детермінують структуру ферментів із близькими функціями, згруповані в бактеріальній хромосомі в одиничний оперон, що забезпечує можливість координованого контролю їхнього вираження відповідно до потреб клітин. До складу названого вище оперона Е. colі входять три гени.
Контрольні питання: 1. Охарактеризувати різновиди систем регуляції обміну речовин мікроорганізмів 2. Охарактеризувати принципи індукції й репресії синтезу ферментних білків
Поиск по сайту: |