|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Хирургические методы реваскуляризации миокарда
Методы хирургической реваскуляризации миокарда получили в последнее время достаточно широкое распространение в клинической практике. Реваскуляризация улучшает выживаемость больных с тяжелым течением и/или серьезным прогнозом заболевания. В клинике чаще используют два метода: чрескожную транслюминальную коронарную ангиопластику (ЧТКА) и аортокоронарное шунтирование (АКШ). Наиболее общими показаниями к проведению реваскуляризации являются ангиографические и клинические признаки, указывающие на высокий риск развития ИМ и внезапной сердечной смерти:
Частым показанием к проведению КАГ и хирургическому вмешательству у больных со стабильной стенокардией напряжения является неэффективность медикаментозной терапии и сохранение выраженных симптомов заболевания, резко ограничивающих физическую активность пациентов. Однако в этих случаях, как правило, имеется угрожающее поражение коронарного русла, т.е. присутствуют ангиографические показания к проведению реваскуляризации. Выбор между двумя методами хирургической реваскуляризации (ЧТКА и АКШ) до сих пор является предметом дискуссий. Полагают, что при одно-двухсосудистом стенозе проксимальных участков КА (за исключением поражения ствола ЛКА) и удовлетворительной функции ЛЖ целесообразно проведение ЧТКА. Эта же процедура является предпочтительной у лиц пожилого возраста или при наличии противопоказаний к расширенному оперативному вмешательству на сердце. При многососудистом стенозировании КА или поражении ствола ЛКА, сочетающихся со снижением ФВ ЛЖ и/или наличием сахарного диабета, более показана операция АКШ. Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) Операция заключается в механическом расширении стенозированного участка КА путем раздувания специального баллончика, введенного в артерию (рис. 5.50). С этой целью осуществляют катетеризацию бедренной или плечевой артерии. Катетер с баллончиком на конце проводят ретроградно через аорту в устье стенозированной КА. Когда баллончик оказывается на уровне стеноза, его несколько раз раздувают под давлением в несколько атмосфер и оставляют в надутом состоянии около 20–30 с. Обычно в результате механического растяжения просвет артерии увеличивается на 50–80%. Во время всей операции осуществляют ангиографический контроль. В настоящее время смертность при проведении процедуры ангиопластики не превышает 0,2–0,6%, острый инфаркт миокарда развивается в 1–2% случаев. Только у 3% больных возникает необходимость в экстренной операции аортокоронарного шунтирования. Первичный эффект (достижение желательной дилатации КА) отмечается в 85–90% случаев, однако в течение ближайших 6–12 месяцев после проведения ангиопластики у 30–40% больных развиваются рестенозы. Чаще они возникают у пациентов, которые были оперированы в период “обострения” ИБС, т.е. у больных с нестабильной стенокардией (см. главу 6). Для того чтобы уменьшить количество рестенозов в последние годы все чаще осуществляют так называемое стентирование — имплантацию в КА, подвергшуюся дилатации, специальных проволочных каркасов–стентов.
Аортокоронарное шунтирование Операция аортокоронарного шунтирования (АКШ) заключается в наложении обходных анастомозов между аортой и пораженной КА дистальнее места ее сужения. Для создания анастомоза обычно используют трансплантат подкожной вены бедра или левой внутренней грудной артерии. Положительный эффект операции АКШ наблюдается в 80–90% случаев, причем более чем у половины оперированных больных на время полностью исчезают клинические проявления болезни. Интраоперационная и послеоперационная летальность во многом зависит от квалификации хирургических бригад и обычно в среднем не превышает 1–3%. Более высокая летальность наблюдается у лиц старше 70 лет, при поражении ствола ЛКА, а также у больных, оперированных по экстренным показаниям в связи с развитием нестабильной стенокардии. Примерно у 4–5% больных в послеоперационном периоде развивается ИМ. При использовании венозных трансплантатов в течение 5 лет окклюзия анастомозов развивается в 20% случаев; через 10 лет их количество достигает 41%. Применение артериальных трансплантатов обеспечивает сохранение проходимости анастомозов в течение 10 лет у 90% оперированных больных.
Прогноз у больных стабильной стенокардией напряжения в целом относительно благоприятный. При отсутствии стеноза ствола ЛКА смертность составляет в среднем около 3% в год. Характерно, что количество приступов стенокардии в неделю не коррелирует с прогнозом до тех пор, пока приступы являются кратковременными и возникают только при физической нагрузке (G.J. Taylor). Основными факторами, ухудшающими прогноз стабильной стенокардии, являются:
Спонтанная (вариантная, вазоспастическая, типа Принцметала) стенокардия была впервые описана в 1959 г. М. Принцметалом. Это особая форма стенокардии покоя, которая возникает внезапно, без действия видимых провоцирующих факторов, и характеризующаяся спазмом КА, тяжелым болевым ангинозным приступом и в большинстве случаев значительным преходящим подъемом сегмента RS–Т на ЭКГ.
В основе вариантной стенокардии лежит выраженный спазм КА, ведущий к ее кратковременной динамической окклюзии. Прекращение или резкое уменьшение коронарного кровообращения приводит к глубокой, часто трансмуральной, ишемии миокарда, снижению локальной сократимости ЛЖ, асинергии сокращений и значительной электрической нестабильности миокарда, проявляющейся нарушением ритма и проводимости. Морфологические изменения венечных сосудов у больных со стабильной стенокардией весьма вариабельны. В одних случаях имеется более или менее выраженный фиксированный стеноз проксимальной КА, обусловленный атеросклеротической бляшкой, суживающей просвет артерии. В других случаях атеросклеротическое сужение крупных КА по данным КАГ может быть минимальным или даже отсутствовать совсем. Не исключено, что в этих случаях спазм КА происходит на уровне мелких интрамуральных (резистивных) венечных сосудов, морфологические изменения которых обычно не фиксируются при КАГ. Механизмы возникновения спазма КА были описаны выше. При спонтанной вазоспастической стенокардии основное значение имеет нарушение функции эндотелия коронарных сосудов, повреждение которого способствует усиленной выработке мощного вазоконстриктора — эндотелина и, наоборот, уменьшению синтеза основного эндотелийзависимого вазодилатирующего фактора — оксида азота (NО), а также снижению выработки простациклина. Значение имеют и другие вазоконстрикторные субстанции, выделяющиеся тромбоцитами, адгезированными и агрегированными в области повреждения сосудистого эндотелия (тромбоксан А2, серотонин и др.). Активация САС и возбуждение α-адренорецепторов коронарных сосудов играет, по-видимому, существенно меньшую роль в возникновении спазма КА, тем более что прием ингибиторов a-адренорецепторов обычно не купирует приступ вазоспастической стенокардии.
Клинические проявления спонтанной (вариантной) стенокардии Принцметала имеют некоторые особенности, отличающие ее от типичной стенокардии напряжения. Интенсивные болевые приступы возникают в покое, чаще ночью во время сна, или в ранние утренние часы (от 4 до 6 ч утра). Болевым приступам обычно не предшествуют какие-либо явные провоцирующие факторы, в том числе те, которые сопровождаются повышением потребности миокарда в кислороде (увеличение ЧСС, подъем АД и др.). Боли, как правило, локализуются за грудиной и иррадиируют в левую руку, плечо и лопатку. Продолжительность боли может быть различной — от 5–10 мин до 20–30 мин. Нередко на фоне болевого приступа возникает брадикардия. Тахикардия может появиться на высоте приступа или в конце его, но лишь как следствие рефлекторной активации САС в ответ на боль, пробуждение или прием нитроглицерина. Боли могут сопровождаться одышкой, слабостью, потливостью, головокружением, что указывает на снижение сократимости ЛЖ и выраженные вегетативные расстройства. Прием нитроглицерина не всегда купирует боль и облегчает состояние больного. Хороший эффект получают от применения блокаторов медленных кальциевых каналов группы нифедипина. Другими частыми проявлениями вариантной стенокардии являются нарушения ритма и проводимости, возникающие во время ангинозного приступа и обусловленные выраженной электрической нестабильностью ишемизированной сердечной мышцы и замедлением проводимости. У больного во время приступа вариантной стенокардии могут развиться преходящие внутрижелудочковые и атриовентрикулярные блокады, частая желудочковая экстрасистолия высоких градаций, пароксизмальная тахикардия или даже фибрилляция желудочков. Внезапное формирование АВ-блокады II или III степени, остановка синусового узла могут сопровождаться синкопальными состояниями. Можно выделить по меньшей мере два клинических варианта течения ИБС у больных со стенокардией Принцметала (рис. 5.51). У половины больных с наличием фиксированного стеноза КА ночные приступы спонтанной стенокардии (спазм) сочетаются с типичной стенокардией напряжения, обусловленной фиксированным стенозом КА и повышением потребности миокарда в кислороде. В этих случаях приступы стенокардии напряжения возникают в дневные часы и обычно провоцируются физической нагрузкой, психоэмоциональным напряжением, подъемом АД, тогда как приступы вариантной стенокардии, обусловленные спазмом КА, возникают спонтанно ночью или под утро (рис. 5.51, а). Толерантность к физической нагрузке у таких больных может быть существенно снижена из-за наличия стеноза КА. Особенно пристального внимания заслуживают случаи, когда у больного, страдающего стенокардией напряжения, впервые появляются описанные приступы спонтанной стенокардии, что обычно указывает на обострение ИБС, вызванное формированием осложненной атеросклеротической бляшки (нестабильная стенокардия). У другой части больных, преимущественно у лиц сравнительно молодого возраста, у которых отсутствует гемодинамически значимое сужение КА, спонтанная вазоспастическая стенокардия может быть единственным клиническим проявлением ИБС, а стенокардия напряжения отсутствует (рис. 5.51, б). Для таких больных, как правило, характерна сравнительно хорошая переносимость физических нагрузок. Физикальные данные у больных вазоспастической стенокардией могут быть самыми разнообразными. Нередко они напоминают таковые при стабильной стенокардии напряжения.
Электрокардиография Наиболее характерным электрокардиографическим признаком спонтанной (вариантной) стенокардии является подъем сегмента RS–Т выше изолинии, свидетельствующий о наличии выраженной трансмуральной ишемии миокарда, обусловленной преходящей динамической окклюзией КА (рис. 5.52). В более редких случаях наблюдается ишемическая депрессия сегмента RS–Т ниже изолинии, что указывает на возникновение субэндокардиальной ишемии, обусловленной неполным перекрытием крупной КА или спазмом более мелких интрамуральных венечных сосудов (мелких артерий и артериол) при хорошем развитии коллатералей. После купирования приступа вазоспатической стенокардии сегмент RS–Т возвращается к изоэлектрической линии (рис. 5.53).
Суточное мониторирование ЭКГ по Холтеру Особенно большое значение для диагностики вазоспастической стенокардии Принцметала имеет метод холтеровского длительного ЭКГ-мониторирования. На ЭКГ во время приступов вариантной стенокардии чаще наблюдается внезапный подъем сегмента RS–T выше изолинии (трансмуральная ишемия), хотя в отдельных случаях может встречаться и его депрессия (субэндокардиальная ишемия). Важно, что эти изменения сегмента RS–T, так же как и приступы стенокардии, развиваются в покое, чаще ночью, и не сопровождаются (по крайней мере, в начале приступа) увеличением ЧСС более чем на 5 ударов в минуту. Это принципиально отличает вазоспастическую стенокардию от приступов стенокардии напряжения, обусловленных повышением потребности миокарда в кислороде. Мало того, приступ вазоспастической стенокардии и ЭКГ-признаки ишемии миокарда могут исчезнуть, несмотря на увеличение ЧСС, обусловленное рефлекторной реакцией на боль, пробуждение и/или прием нитроглицерина (феномен “прохождения через боль”). Непрерывная запись ЭКГ позволяет выявить еще один важный отличительный признак стенокардии Принцметала: смещение сегмента RS–T в начале приступа происходит очень быстро, скачкообразно и так же быстро исчезает после окончания спастической реакции. Для стенокардии напряжения, наоборот, характерно плавное постепенное смещение сегмента RS–T при повышении потребности миокарда в кислороде (увеличении ЧСС) и столь же медленное возвращение его к исходному уровню после купирования приступа. Функциональные нагрузочные тесты У значительного числа больных с вазоспастической формой стенокардии пробы с дозированной физической нагрузкой оказываются отрицательными. Это связано с отсутствием у этих пациентов гемодинамически значимого органического сужения просвета венечных сосудов, а также с тем, что физическая нагрузка и увеличение ЧСС достаточно редко могут спровоцировать приступ вариантной стенокардии, сопровождающейся выраженным спазмом КА. Только у Следующие функциональные пробы используют для провокации спазма КА. Холодовая проба. Руку пациента до середины предплечья помещают на 3–5 мин в воду, охлажденную до температуры +4°С. ЭКГ регистрируют в течение 10 мин после окончания холодового воздействия. Проба отличается низкой чувствительностью, поскольку ишемические изменения сегмента RS–Т выявляются примерно у 15–20% больных вазоспастической стенокардией. Пробу с эргометрином(см. выше) считают наиболее адекватной для выявления вазоспастических реакций, в частности, у больных ИБС, у которых во время коронароангиографии не обнаруживается стенозирование КА. Проба с эргометрином опасна развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии), в связи с чем она используется для диагностики ИБС только в специализированных научно-исследовательских учреждениях (Д.М. Аронов с соавт., 1996). На рис. 5.54 приведены ЭКГ и КАГ больного с выраженным спазмом КА, возникшим во время эргометринового теста.
Основой медикаментозной терапии больных вазоспастической стенокардией Принцметала являются блокаторы медленных кальциевых каналов. Эффективными могут оказаться любые препараты группы верапамила, нифедипина или дилтиазема, в том числе их сочетание. Предпочтительно использовать антагонисты кальция пролонгированного действия (ретардные формы). Приступы ночной стенокардии покоя обычно купируются приемом нитроглицерина. В этих случаях нитроглицерин выступает как артериолярный вазодилататор, устраняющий спазм КА. Его влияние на венозный возврат крови и величину преднагрузки при вариантной стенокардии большого значения не имеет, за исключением тех случаев, когда динамический стеноз КА (спазм) возникает на фоне одновременно существующего фиксированного стеноза, обусловленного атеросклеротической бляшкой, суживающей просвет сосуда. Для профилактики приступов вазоспастической стенокардии Принцметала используют нитраты пролонгированного действия. При этом следует помнить, что в большинстве случаев необходимо предусмотреть прием нитратов в вечернее время, а не утром и днем, как при стабильной стенокардии напряжения. Возможна комбинация ретардных форм нитратов с одним или даже двумя блокаторами медленных кальциевых каналов, например нитраты + нифедипин + верапамил или нитраты + нифедипин + дилтиазем. В некоторых случаях целесообразно применение блокаторов a-адренорецепторов, например празозина или доксазозина (подробное описание этих ЛС приведено в главе 7). Следует помнить, что в отличие от больных стабильной стенокардией напряжения, у пациентов с вазоспастической стенокардией применение b-адреноблокаторов может резко ухудшить состояние. Это объясняется тем, что блокада b-адренорецепторов может способствовать преобладанию a-адренергической стимуляции КА, которая приводит к возникновению спазма. Для профилактики острого коронарного синдрома у больных вазоспастической стенокардией Принцметала целесообразно использовать курантил, обладающий не только мощным антитромбоцитарным эффектом, но и выраженными вазодилатационными свойствами. Препарат принимают в дозе 225 мг в сутки. Хирургическое лечение больных со стенокардией Принцметала, как правило, неэффективно. Склонные к спазму КА очень чувствительны к различным механическим манипуляциям. Поэтому у таких пациентов любое оперативное вмешательство может привести к развитию ИМ и жизнеопасных желудочковых аритмий. Только в тех случаях, когда органическое сужение КА явно преобладает, и спазм развивается в области атеросклеротического стеноза, следует рассмотреть вопрос о возможности проведения ангиопластики со стентированием или аортокоронарного шунтирования.
Прогноз при вариантной стенокардии определяется двумя основными факторами:
Если у больного имеют место тяжелые, длительные или впервые возникшие и повторяющиеся приступы стенокардии Принцметала, которые могут быть отнесены к нестабильной стенокардии, прогноз достаточно серьезен: у 20–25% больных в течение 3-х месяцев развивается ИМ или наступает внезапная сердечная смерть. При стабильном характере вариантной стенокардии редкие и легко купирующиеся болевые приступы под влиянием лечения прекращаются, иногда на многие годы, и прогноз определяется степенью коронарной обструкции и числом пораженных КА. 7-летняя выживаемость таких больных достигает 97%.
Безболевая ишемия миокарда (БИМ) — это эпизоды транзиторной кратковременной ишемии сердечной мышцы, объективно выявляемые с помощью некоторых инструментальных методов исследования, но не сопровождающиеся приступами стенокардии или ее эквивалентами. Феномен БИМ обнаруживается не менее чем у 2/3 больных ИБС со стабильной и нестабильной стенокардией и у 1/3 больных с постинфарктным кардиосклерозом. В большинстве случаев у одного и того же больного наблюдается сочетание как безболевой ишемии миокарда, так и болевых ангинозных приступов (стенокардии). Причем, лишь небольшая часть эпизодов преходящей ишемии сопровождаются приступами стенокардии (не более чем 20–25% от общего числа эпизодов ишемии), тогда как на долю БИМ приходится около 75–80%. Кроме того, у некоторых пациентов, страдающих ИБС, в течение длительного времени заболевание вообще протекает бессимптомно, приступы стенокардии отсутствуют, и эпизоды безболевой ишемии миокарда являются практически единственным проявлением заболевания. Таким образом, БИМ относится к числу не менее распространенных, чем стенокардия, проявлений коронарной недостаточности.
Механизмы возникновения недостаточности коронарного кровообращения во время доказанных эпизодов БИМ аналогичны таковым у больных со стабильной или вазоспастической стенокардией:
Причины отсутствия болевого синдрома во время преходящей ишемии миокарда до сих пор не совсем ясны. У больных с эпизодами БИМ, вероятнее всего, имеет значение повышенное содержание опиоидных субстанций, снижение чувствительности болевых рецепторов (ноцицепторов) и повышение порога болевой чувствительности. В основе болевого синдрома при стенокардии лежит возникновение преходящей кратковременной ишемии миокарда, вызванной абсолютным или относительным уменьшением коронарного кровообращения и/или увеличением потребности миокарда в кислороде. В очаге ишемии происходит высвобождение ряда химических субстанций, обладающих свойствами медиаторов боли. Главными из них являются серотонин, гистамин, брадикинин, источником которых служат тромбоциты, базофильные лейкоциты и тканевые тучные клетки. Если медиаторы боли выделяются в достаточном количестве, происходит возбуждение специфических болевых рецепторов — ноцицепторов.Причем их чувствительность во многом зависит от концентрации в окружающей рецепторы среде ионов К+ и Н+, а также от содержания простагландинов, образующихся в процессе активированного усиления метаболизма арахидоновой кислоты. Считают, что простагландины являются своеобразными модуляторами освобождения и функционирования медиаторов боли в ноцицепторах. Из очага ишемии болевые импульсы переносятся по афферентным волокнам сердечных нервов к паравертебральной цепочке шейных и грудных ганглиев, затем по спиноталамическому тракту спинного мозга к заднебоковым и передним ядрам таламуса и к коре головного мозга, где и формируется болевое ощущение. Интересно, что в передаче болевого возбуждения на уровне спинного мозга и таламуса важное место отводится так называемой субстанции Р, которая является физиологическим медиатором для волокон чувствительных нейронов задних корешков спинного мозга. Степень освобождения субстанции Р из нервных окончаний чувствительных волокон регулируется опиоидными нейропептидами — энкефалинами и эндорфинами, которые в норме обнаруживаются в головном и спинном мозге. Они препятствуют освобождению субстанции Р и, следовательно, могут регулировать поступление болевых импульсов в таламус и кору головного мозга. Эти факторы оказывают существенное влияние на характер и интенсивность болевого приступа и в некоторых случаях могут вообще препятствовать его возникновению, несмотря на наличие в сердце очага ишемии.
Клинические проявления ИБС у лиц с доказанными эпизодами БИМ в целом мало отличаются от таковых, выявляемых у пациентов со стабильной стенокардией напряжения, тем более что в большинстве случаев болевые и безболевые эпизоды транзиторной ишемии встречаются у одних и тех же больных. В то же время считается, что преобладание БИМ прогностически является весьма неблагоприятным фактором у больных со всеми формами ИБС (А.Л. Верткин с соавт., 2000). Так, увеличение частоты эпизодов БИМ и их суммарной продолжительности ассоциируется с более высоким функциональным классом стенокардии, с более частым многососудистым поражением коронарного русла, с нарушениями ритма сердца, а также с наличием ряда ФР атеросклероза (АГ, ГЛП, сахарный диабет, курение и т.п.). В соответствии с этим у пациентов с доказанными эпизодами БИМ при клиническом обследовании несколько чаще можно выявить признаки:
К числу современных инструментальных методов неинвазивной диагностики, позволяющих объективно доказать наличие у больных ИБС эпизодов БИМ, относятся: 1.Суточное мониторирование ЭКГ по Холтеру. 2. Функциональные нагрузочные тесты (тредмил, велоэргометрия, добутаминовый тест и др.). 3. Стресс-эхокардиография. 4. Нагрузочная сцинтиграфия миокарда с 201Тl. Таблица 5.12 Чувствительность и специфичность диагностики БИМ у больных ИБС с помощью различных инструментальных методов
Чувствительность и специфичность каждого из этих методов в выявлении БИМ не одинакова (табл. 5.12). Классическим методом выявления БИМ является суточное мониторирование ЭКГ по Холтеру, позволяющее оценить изменения электрической активности миокарда в повседневной жизни пациента и на протяжении длительного времени. Критерием БИМ считается горизонтальное или косонисходящее смещение сегмента RS–Т ниже изоэлектрической линии более чем на 1,0 мм на протяжении 80 мс от точки соединения (J), которое не сопровождается появлением болевого приступа. В этих случаях можно думать о наличии преходящей безболевой субэндокардиальной ишемии миокарда, индуцированной физической нагрузкой, стрессом, обильным приемом пищи, курением и другими факторами, повышающими потребность миокарда в кислороде и способствующими активации САС. Подъем сегмента RS–Т рассматривается как результат трансмуральной безболевой ишемии миокарда, чаще возникающей в результате динамической окклюзии проксимальной КА, обусловленной ее спазмом. Установлено, что большая часть эпизодов БИМ возникает рано утром между 6 и 9 часами и только около 10% — в ночное время. Чувствительность выявления БИМ с помощью холтеровского мониторирования ЭКГ достигает 75%, специфичность — 85%. Следует упомянуть еще об одной области применения холтеровского ЭКГ-мониторирования у пациентов с БИМ, результаты которого могут использоваться для оценки эффективности антиангинальной терапии. При этом учитывают количество и общую продолжительность зарегистрированных эпизодов ишемии миокарда, соотношение числа болевых и безболевых эпизодов ишемии, число нарушений ритма и проводимости, возникающих в течение суток, а также суточные колебания ЧСС и другие признаки. Особое внимание следует обращать на наличие пароксизмов бессимптомной ишемии миокарда, поскольку известно, что у некоторых больных, прошедших курс лечения, наблюдается уменьшение или даже исчезновение приступов стенокардии, но сохраняются признаки безболевой ишемии сердечной мышцы. Повторные исследования с помощью холтеровского мониторирования ЭКГ особенно целесообразны при назначении и подборе дозы блокаторов β-адренорецепторов, влияющих, как известно, на ЧСС и проводимость, поскольку индивидуальную реакцию на эти препараты трудно предсказать и не всегда легко выявить с помощью традиционного клинического и электрокардиографического методов исследования. Функциональные нагрузочные пробы (тредмил-тест, велоэргометрия, фармакологические тесты) наиболее часто используют в клинике для диагностики как болевой, так и безболевой ишемии миокарда. Для диагностики БИМ обычно используют те же критерии ишемии миокарда, что и при холтеровском мониторировании (депрессия или подъем сегмента RS–Т на 1,0 мм и больше на протяжении 80 мс от точки соединения — J). Чувствительность метода составляет 62%, специфичность — 80%. Стресс-эхокардиография. У большинства больных ИБС с эпизодами БИМ на высоте функционального нагрузочного теста удается выявить локальные нарушения сократимости ЛЖ, чаще в виде гипокинезии миокарда. Методика стресс-эхокардиографии позволяет также оценить изменения глобальной систолической функции ЛЖ, возникающие во время нагрузочного теста. Уменьшение ФВ на высоте нагрузки является важным диагностическим признаком, указывающим на возникновение ишемии миокарда. Нагрузочная сцинтиграфия миокарда с 201Тl является наиболее точным неинвазивным методом диагностики преходящих нарушений коронарного кровообращения, в том числе БИМ. Методика проведения исследования ничем не отличается от таковой у больных стабильной стенокардией напряжения (см. выше). При возникновении БИМ на фоне физической нагрузки или во время проведения дипиридамолового теста на сцинтиграммах выявляются локальные дефекты накопления 201Тl.Чувствительность метода достигает 90%, специфичность — 85%. Таким образом, для наиболее полной и всесторонней оценки состояния коронарного кровообращения у больных ИБС, в том числе у пациентов с БИМ, целесообразно использовать комплекс описанных выше неинвазивных методов исследования. Каждый из этих методов, помимо объективного установления факта болевой или безболевой ишемии миокарда, дает возможность описать некоторые индивидульные особенности возникновения ишемии миокарда. Так, функциональные нагрузочные тесты (велоэргометрия, тредмил-тест и др.) позволяют получить дополнительную информацию о толерантности к физической нагрузке, величине коронарного резерва и (косвенно) о степени фиксированного стеноза КА. Длительное мониторирование ЭКГ по Холтеру дает возможность оценить суммарную продолжительность ишемии миокарда, соотношение болевых и безболевых эпизодов ишемии. Кроме того, холтеровское мониторирование ЭКГ позволяет зарегистрировать эпизоды БИМ, возникающие в покое, нередко обусловленные выраженным преходящим спазмом КА (кратковременный подъем сегмента RS–Т). Наконец, с помощью методики стресс-ЭхоКГ и нагрузочной сцинтиграфии миокарда с 201Тl удается описать локализацию и распространенность ишемического повреждения сердечной мышцы.
Поскольку патогенетические механизмы возникновения болевой и безболевой ишемии миокарда едины, основные принципы лечения больных с БИМ не отличаются от таковых при стабильной стенокардии напряжения. Необходимо предусмотреть весь комплекс немедикаментозного и медикаментозного лечения, включая применение антиагрегантов, антиангинальных средств, цитопротекторов, а также коррекцию ФР ИБС. В реальных клинических условиях у больных с БИМ это осуществить гораздо сложнее, поскольку отсутствует естественный и простой критерий эффективности лечения — уменьшение приступов стенокардии. Это существенно повышает роль дополнительных методов диагностики (нагрузочных тестов, холтеровского мониторирования ЭКГ и др.) в осуществлении контроля за эффектом лечения.
По современным данным, по меньшей мере у 1/3 больных с БИМ в дальнейшем развивается типичная стенокардия, ИМ или наступает внезапная смерть. Как было сказано выше, наличие безболевой ишемии миокарда повышает риск внезапной смерти в 5–6 раз, аритмий — в 2 раза, развитие ИМ и ХСН — в 1,5 раза по сравнению с риском у больных стабильной стенокардией напряжения. Соответственно, летальность этих больных колеблется от 2,7% до 9% в год.
Микроваскулярная стенокардия (“синдром Х”) — это особая форма ИБС, которая встречается примерно в 10–15% случаев и характеризуется: 1) отсутствием типичных атеросклеротических изменений крупных (эпикардиальных) КА и 2) наличием выраженных функциональных и морфологических расстройств дистально расположенных мелких КА.
Как было сказано выше (см. раздел 5.2), при микроваскулярной стенокардии основные морфологические и функциональные изменения происходят на уровне сравнительно мелких КА — преартериол, в связи с чем эти изменения не выявляются при коронароангиографии. Морфологические изменения преартериол характеризуются значительным сужением их просвета за счет гипертрофии и гиперплазии гладкомышечных клеток, а также выраженного фиброза медии. В результате в коронарном русле повышается сосудистое сопротивление и нарушается кровоток. Преартериолы при этом теряют способность расширяться в ответ на увеличение потребности миокарда в кислороде. Характерна значительная неравномерность описанных морфологических изменений в преартериолах различных участков сердечной мышцы. Возникновению описанной дисфункции микроциркуляторного сосудистого русла способствует повышение агрегации тромбоцитов и ухудшение реологических свойств крови. Причина описанных нарушений до сих пор остается невыясненной, хотя имеются данные о том, что возникновение микроваскулярной стенокардии ассоциируется с наличием у больного признаков метаболического синдрома (см. выше). Поскольку клиническая картина и последствия микроваскулярной дисфункции очень напоминают изменения, наблюдающиеся при атеросклеротическом поражении крупных КА, данный симптомокомплекс в настоящее время принято расценивать как одну из форм ИБС. Не исключено, что поражение дистального коронарного русла имеет место и при других формах ИБС, особенно у больных с метаболическим синдромом (сочетание инсулинорезистентности, ожирения, АГ и сахарного диабета). В то же время существует мнение, что “синдром Х” является самостоятельным заболеванием.
Микроваскулярная стенокардия чаще развивается у женщин, причем преимущественно в пременопаузальном периоде. В большинстве случаев имеет место атипичный болевой синдром, существенно отличающийся от типичных приступов стенокардии напряжения. Боль в большинстве случаев провоцируется эмоциональным напряжением, тогда как толерантность к физической нагрузке остается высокой. Нередко боли развиваются в покое и продолжаются больше 20–30 мин. Нитроглицерин не всегда полностью купирует приступы микроваскулярной стенокардии. Нередко болевой синдром сочетается с признаками тревожно-мнительного состояния, эмоциональной лабильностью, раздражительностью. Электрокардиография. На ЭКГ, зарегистрированной в покое, могут определяться неспецифические изменения зубца Т, а также небольшая депрессия сегмента RS–T, не превышающая 0,5–1,0 мм. При регистрации суточной ЭКГ по Холтеру определяются эпизоды болевой и безболевой ишемии миокарда в виде диагностически значимой депрессии сегмента RS–Т. Тесты с физической нагрузкой оказываются положительными не более чем в 20% случаев, а толерантность к физической нагрузке, как правило, существенно выше, чем у больных с типичной стенокардией напряжения. Тесты с предсердной стимуляцией (ЧПЭС) по некоторым данным (М.Г. Полтавская и И.Г. Аллилуев, 1993) положительны более чем у 2/3 больных микроваскулярной стенокардией. При этом возникновение ишемии миокарда в половине случаев сопровождается увеличением содержания лактата в крови, взятой из коронарного синуса во время катетеризации сердца, что подтверждает наличие ишемического очага в сердечной мышце. Фармакологические нагрузочные тесты (дипиридамоловая проба и проба с эргометрином) в большинстве случаев бывают положительными. Положительные результаты дипиридамолового теста свидетельствуют о возникновении синдрома межкоронарного “обкрадывания”, а пробы с эргометрином — о склонности коронарных сосудов к спастическим реакциям. Характерно, что в отличие от вазоспастической стенокардии Принцметала, при которой введение эргометрина вызывает спазм крупной КА и подъем сегмента RS–Т, при микроваскулярной стенокардии эргометрин вызывает депрессию сегмента RS–Т, свидетельствуя о возникновении субэндокардиальной ишемии миокарда (рис. 5. 55).
В неясных случаях преходящая ишемия миокарда может быть подтверждена при проведении нагрузочной сцинтиграфии миокарда с 201Тl. Коронароангиография. Главной находкой, выявляемой при селективной КАГ, является отсутствие атеросклеротического сужения проксимальных (эпикардиальных) КА. Следует помнить, что положительные результаты тестов с физической нагрузкой, дипиридамолом и эргометрином, а также нагрузочной сцинтиграфии миокарда с 201Тl позволяют достоверно подтвердить диагноз микроваскулярной стенокардии только тогда, когда при проведении КАГ не обнаруживают типичных атеросклеротических изменений крупных КА.
Лечение больных микроваскулярной стенокардией принципиально почти не отличается от терапии других форм ИБС стабильного течения. Должны быть предусмотрены коррекция ФР ИБС, применение антитромбоцитарных ЛС, нитратов, β-адреноблокаторов, блокаторов медленных кальциевых каналов, цитопротекторов, при необходимости ингибиторов АПФ и статинов. Особое значение в лечении приобретает терапия антиагрегантами (аспирин, клопидогрель) и цитопротекторами (триметазидин). Пристального внимания требует контроль уровня АД и коррекция нарушений углеводного и липидного обмена.
Прогноз при микроваскулярной стенокардии в целом весьма благоприятный. 7-летняя выживаемость составляет 96%, что мало отличается от соответствующего показателя у больных стабильной стенокардией напряжения. Заболевание очень редко приводит к инвалидизации.
Глава 6. Ишемическая болезнь сердца: нестабильная стенокардия, инфаркт миокарда, внезапная смерть
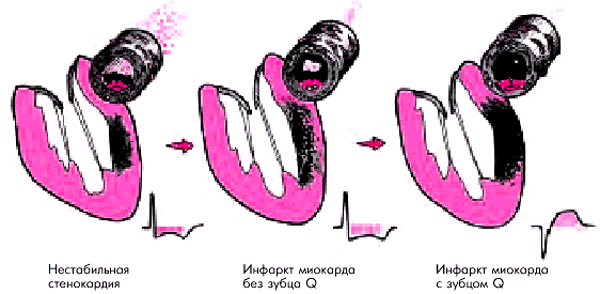
Ишемическая болезнь сердца в большинстве случаев протекает с периодами стабильного течения заболевания и обострения (рис. 6.1). Периоды стабильного течения характеризуются постепенным увеличением размеров атеросклеротических бляшек, суживающих просвет КА, медленным прогрессированием фиброза сердечной мышцы и компенсаторной гипертрофии кардиомиоцитов. Клинически в этот период наблюдается стабильная стенокардия напряжения или другие формы транзиторной болевой или безболевой ишемии миокарда (см. главу 5), а в части случаев — медленное прогрессирование сердечной недостаточности и нарушений сердечного ритма и проводимости.
Периоды обострения ИБС характеризуются сравнительно быстрым формированием так называемой “осложненной” атеросклеротической бляшки с нарушением целостности ее фиброзной оболочки (разрывы, эрозии) и образованием на месте повреждений пристеночного или окклюзирующего просвет сосуда тромба. В зависимости от скорости формирования и размеров тромба, продолжительности его существования в просвете сосуда, степени ограничения коронарного кровотока, выраженности коллатерального кровотока и других факторов клинически обострение ИБС проявляется:
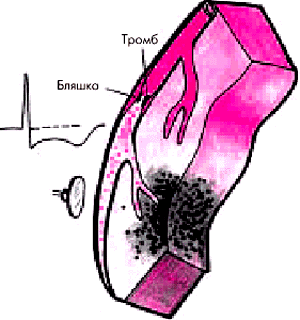
Для нестабильной стенокардии (НС) характерно формирование в КА пристеночного тромбоцитарного (“белого”) тромба, который в большинстве случаев спонтанно или под влиянием лечения подвергается тромболизису (рис. 6.2). Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время (до 1 ч), развивается нетрансмуральный ИМ без зубца Q. Наконец, если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q (Е.П. Панченко). Таким образом, в основе всех перечисленных выше клинических проявлений обострения ИБС (НС, ИМ, внезапной смерти) лежит единый патофизиологический механизм острого нарушения коронарного кровообращения, а именно: тромбоз КА, развивающийся на фоне осложненной атеросклеротической бляшки с надрывами и изъязвлениями ее фиброзной оболочки, выпадением содержимого липидного ядра в просвет сосуда и/или повреждением эндотелия. В связи с этим в последние годы принято объединять различные клинические проявления обострения ИБС понятием “острый коронарный синдром”.
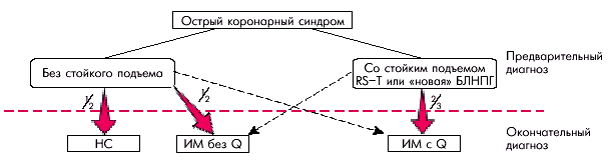
Термин “острый коронарный синдром” был введен в клиническую практику в конце 80-х годов прошлого века, когда стало ясно, что вопрос о применении некоторых активных методов лечения (например, тромболитической терапии или первичной коронарной ангиопластики) должен решаться до установления окончательного диагноза — наличия или отсутствия ИМ (Российские рекомендации комитета экспертов ВНОК, 2001). Иными словами, острый коронарный синдром — это лишь предварительный диагноз, помогающий выбрать оптимальную тактику ведения больных в самые первые часы от начала обострения заболевания, когда точно подтвердить или отвергнуть диагноз ИМ или НС не представляется возможным. В зависимости от результатов первоначального клинического обследования и регистрации ЭКГ в 12 отведениях, больные с острыми коронарными синдромами могут быть отнесены к одной из двух категорий пациентов с обострением ИБС: 1. Острый коронарный синдром со стойким подъемом сегмента RS–T или “новой”, впервые возникшей блокадой левой ножки пучка Гиса. 2. Острый коронарный синдром без стойкого подъема сегмента RS–T. Острый коронарный синдром со стойким подъемом сегмента RS–T. Пациенты, относящиеся к первой из этих категорий, имеют существенно более серьезный прогноз. Стойкая элевация (подъем) сегмента RS–T свидетельствует, как известно, о возникновении достаточно распространенной и “глубокой”, трансмуральной, ишемии миокарда, которая обусловлена прекращением коронарного кровотока в бассейне одной из КА, как правило, за счет тромба, полностью окклюзирующего просвет сосуда (рис. 6.3, а), или при сочетании неокклюзирующего тромба и выраженного длительного спазма КА (динамический стеноз) (рис. 6.3, б).
Следует заметить, что в этих последних случаях речь не идет об обычном, относительно кратковременном, приступе вазоспастической стенокардии Принцметала, который, как известно, также сопровождается преходящим подъемом сегмента RS–T (см. главу 5). Для отнесения больного к данной категории острого коронарного синдрома необходимо зарегистрировать именно стойкий подъем RS–T. Понятно, что в отдельных случаях пациенты с длительным затянувшимся и не купирующимся приступом вазоспастической стенокардии и “стойкими” изменениями на ЭКГ также должны быть отнесены к данной категории больных острым коронарным синдромом. Внезапное появление на ЭКГ “новой” блокады левой ножки пучка Гиса на фоне клинической картины явного обострения заболевания также с определенной степенью вероятности свидетельствует о полной окклюзии КА. Было установлено, что более чем у 2/3 больных острым коронарным синдромом со стойким подъемом сегмента RS–T или “новой” блокадой развивается ИМ, причем в подавляющем большинстве случаев — трансмуральный ИМ с зубцом Q (Savantto с соавт., 1999). Лишь в небольшом проценте случаев исходом данной формы острого коронарного синдрома является НС. Поэтому основной целью лечения этих больных, еще до установления точного диагноза ИМ, является по возможности быстрое и полное восстановление коронарного кровотока с помощью тромболитической терапии или первичной ангиопластики (см. ниже). Острый коронарный синдром без стойкого подъема сегмента RS–T. К категории острого коронарного синдрома без стойкого подъема сегмента RS–T относят пациентов с болями в грудной клетке и/или внезапно появившимися изменениями на ЭКГ, свидетельствующими об острой ишемии миокарда. У таких больных на ЭКГ, зарегистрированной в покое, может наблюдаться стойкая или преходящая депрессия сегмента RS–T и/или инверсия зубца Т, но отсутствует стойкий подъем RS–T. В некоторых случаях ЭКГ может оказаться малоизмененной, тогда как в других случаях, наоборот, диагноз данной категории острого коронарного синдрома может быть поставлен при наличии безболевых ишемических изменений. В основе возникновения острой ишемии миокарда у этих больных лежит формирование неокклюзирующего пристеночного, преимущественно тромбоцитарного (“белого”) тромба, причем, как правило, в области расположения осложненной атеросклеротической бляшки (см. рис. 6.4). В результате возникает преимущественно субэндокардиальная (нетрансмуральная) ишемия сердечной мышцы. В последующем у большинства больных острым коронарным синдромом без стойкого подъема сегмента RS–T возможно возникновение либо нестабильной стенокардии, либо острого ИМ без зубца Q. Эти две формы ИБС (НС и ИМ без зубца Q) различаются между собой по отсутствию или наличию маркеров некроза (повышенных уровней тропонинов, МВ КФК и КФК). Установлено, что у больных острым коронарным синдромом без стойкого подъема сегмента RS–T применение тромболитической терапии малоэффективно. Лечение таких больных должно быть направлено на устранение выраженной ишемии миокарда и предотвращение процесса дальнейшего тромбообразования.
6.2. Патогенез острых коронарных синдромов
Как было показано выше, морфологической основой всех перечисленных вариантов острого коронарного синдрома является “осложненная” атеросклеротическая бляшка, оболочка которой подвергается повреждению. Разрыв атеросклеротической бляшки или эрозия ее оболочки и последующий стеноз или окклюзия КА происходят под действием ряда факторов, к числу которых относятся:
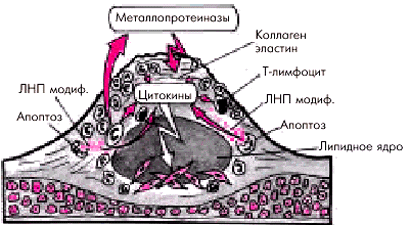
Активная воспалительная реакцияв атеросклеротической бляшке является, по-видимому, одним из ведущих факторов, ослабляющих фиброзную капсулу бляшки и способствующих ее разрыву. Фиброзная оболочка атеросклеротической бляшки, в состав которой входит большое количество коллагена и эластина, является сравнительно прочным образованием и способна выдерживать достаточно большое напряжение. Ее ослабление происходит в результате местной воспалительной реакции, когда фиброзная оболочка, непосредственно граничащая с просветом сосуда, инфильтрируется макрофагами, пенистыми клетками, Т-лимфоцитами. Риск разрыва атеросклеротической бляшки существенно увеличивается, если количество макрофагов и других клеток в оболочке превышает 15% от общей поверхности бляшки. Макрофаги, как известно, продуцируют цитокины, в том числе γ-интерферон, интерлейкин 1, фактор некроза опухолей α (ФНОα), которые:
Макрофаги вырабатывают протеолитические ферменты — металлопротеиназы (коллагеназу, эластазу, желатиназу, стромелизин и др.), которые способствуют разрушению коллагена и эластина фиброзной оболочки и повреждению ее внеклеточного матрикса (рис. 6.6). Одним из мощных стимуляторов воспаления являются окисленные (модифицированные) ЛНП и ЛП (α), которые освобождаются в большом количестве в результате гибели макрофагов и пенистых клеток. Ослабление и разрыв фиброзной капсулы под действием протеолитических ферментов, выделяемых макрофагами, получили название “активного разрыва” бляшки.
“Механическая усталость” фиброзной оболочки. Оболочка атеросклеротической бляшки постоянно подвергается сжатию и растяжению во время сокращения сердца. Этот эффект усиливается при тахикардии, повышении АД, ускорении кровотока, а также при воздействии других гемодинамических факторов. Ослаблению оболочки способствует также наличие большого и все увеличивающегося липидного ядра бляшки, истончение оболочки. Имеет значение форма и локализация атеросклеротической бляшки: чаще подвергаются разрыву бляшки, эксцентрически расположенные в просвете сосуда. Особенно часто гемодинамически обусловленные надрывы происходят в области, непосредственно граничащей с интактным эндотелием (рис. 6.7).
Следует помнить, что причиной острого коронарного синдрома может быть не только разрыв оболочки, но и эрозия эндотелия бляшки которая, по данным аутопсий, встречается почти в половине случаев внезапной сердечной смерти и у 25% больных острым ИМ. Особенно часто эрозия бляшки как причина острого коронарного синдрома встречается у женщин. Кровоизлияние внутри бляшки.В главе 4 было показано, что в процессе формирования атеросклеротической бляшки в ней постепенно образуются микрососуды, которые отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. В результате кровоизлияний внутри бляшки резко увеличиваются ее размеры и повреждается оболочка. Спазм коронарной артериив области поврежденной атеросклеротической бляшки существенно ограничивает коронарный кровоток, способствуя возникновению динамического стеноза или динамической окклюзии (рис. 6.8). На рисунке видно, что практически полное прекращение кровотока по артерии может наступить при уменьшении радиуса артерии всего на 20%, даже если органическое сужение до возникновения спазма не превышало 50% просвета сосуда. Причиной характерного для острого коронарного синдрома спазма КА является в первую очередь выраженная дисфункция эндотелия со снижением продукции дилатирующих субстанций (NO, простациклина и др.) и преобладанием вазоконстрикторов (эндотелина, ангиотензина II и др.). Решающее значение в возникновении выраженного и длительного спазма КА имеют тромбоциты, агрегация которых приводит к высвобождению ряда веществ, обладающих выраженным вазоконстрикторным действием (тромбоксана А2, тромбина и др.). Не исключено, что спазм КА может выполнять роль своеобразного триггера разрыва атеросклеротической бляшки.
Образование тромба в области разрыва или эрозии атеросклеротической бляшки является решающим событием в общей последовательности формирования острых коронарных синдромов. Процесс образования тромба претерпевает несколько стадий.
Поиск по сайту: |






 больных на высоте нагрузки удается спровоцировать приступ вазоспастической стенокардии и/или подъем сегмента RS–Т. Чрезвычайно характерным для таких случаев является постоянное, изо дня в день и даже в течение одного дня, колебание толерантности к физической нагрузке, т.е. быстрое изменение степени коронарного резерва. Такие колебания обусловлены постоянно меняющимся тонусом КА и, соответственно, степенью динамической обструкции просвета сосуда, которая как бы “добавляется” к величине фиксированного стеноза венечного сосуда, обусловленного органическим стенозом.
больных на высоте нагрузки удается спровоцировать приступ вазоспастической стенокардии и/или подъем сегмента RS–Т. Чрезвычайно характерным для таких случаев является постоянное, изо дня в день и даже в течение одного дня, колебание толерантности к физической нагрузке, т.е. быстрое изменение степени коронарного резерва. Такие колебания обусловлены постоянно меняющимся тонусом КА и, соответственно, степенью динамической обструкции просвета сосуда, которая как бы “добавляется” к величине фиксированного стеноза венечного сосуда, обусловленного органическим стенозом.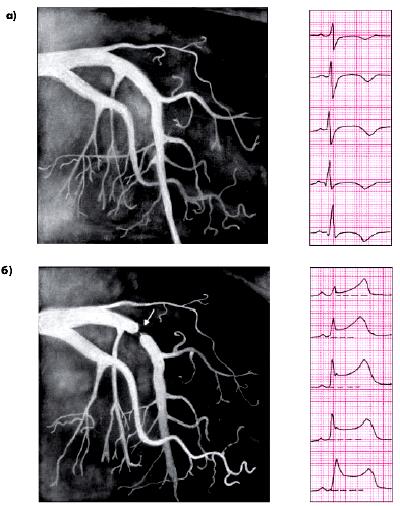
 Запомните
1. Эпизоды безболевой ишемии миокарда (БИМ) выявляются у большинства больных ИБС, причем, как правило, их частота и продолжительность превышают частоту и длительность болевых ангинозных приступов (стенокардии). 2. БИМ является прогностически неблагоприятным фактором у больных со всеми клиническими формами ИБС, повышая риск внезапной сердечной смерти, аритмий и застойной сердечной недостаточности.
3. Эпизоды БИМ удовлетворительно выявляются с помощью:
Запомните
1. Эпизоды безболевой ишемии миокарда (БИМ) выявляются у большинства больных ИБС, причем, как правило, их частота и продолжительность превышают частоту и длительность болевых ангинозных приступов (стенокардии). 2. БИМ является прогностически неблагоприятным фактором у больных со всеми клиническими формами ИБС, повышая риск внезапной сердечной смерти, аритмий и застойной сердечной недостаточности.
3. Эпизоды БИМ удовлетворительно выявляются с помощью: