|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Позитронная эмиссионная томография. Позитронная эмиссионная томография (ПЭТ) — относительно новый и высокоинформативный
Позитронная эмиссионная томография (ПЭТ) — относительно новый и высокоинформативный неинвазивный метод исследования метаболизма сердечной мышцы, поглощения кислорода и коронарной перфузии. Метод основан на регистрации лучевой активности сердца после введения специальных радиоактивных меток, которые включаются в те или иные обменные процессы (гликолиз, окислительное фосфорилирование глюкозы, β-окисление жирных кислот и т.д.), имитируя “поведение” основных метаболических субстратов (глюкозы, жирных кислот и т.п.). У больных ИБС метод ПЭТ позволяет неинвазивным способом изучать региональный миокардиальный кровоток, метаболизм глюкозы и жирных кислот, поглощение кислорода. ПЭТ оказалась незамененимым методом в диагностике жизнеспособности миокарда. Так например, когда нарушение локальной сократимости ЛЖ (гипокинезия, акинезия) обусловлено гибернирующим или оглушенным миокардом, сохранившим свою жизнеспособность, при ПЭТ можно зарегистрировать метаболическую активность данного участка сердечной мышцы (рис. 5.32), тогда как при наличии рубца такая активность не выявляется.
Эхокардиография Эхокардиографическое исследование у больных ИБС позволяет получить важную информацию о морфологических и функциональных изменениях в сердце. С помощью эхокардиографии (ЭхоКГ) диагностируют:
Получение столь обширной информации возможно только при комплексном использовании трех основных режимов эхокардиографии: одномерного (М-режима), двухмерного (В-режима) и допплеровского режима. Оценка систолической и диастолической функции левого желудочка Систолическая функция ЛЖ. Основными гемодинамическими показателями, отражающими систолическую функцию ЛЖ, являются ФВ, УО, МО, СИ, а также конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. Эти показатели получают при исследовании в двухмерном и допплеровском режимах по методике, подробно описанной в главе 2. Как было показано выше, наиболее ранним маркером систолической дисфункции ЛЖ является уменьшение фракции выброса (ФВ) до 40–45% и ниже (табл. 2.8), которое обычно сочетается с увеличением КСО и КДО, т.е. с дилатацией ЛЖ и его объемной перегрузкой. При этом следует иметь в виду сильную зависимость ФВ от величины пред- и постнагрузки: ФВ может уменьшаться при гиповолемии (шок, острая кровопотеря и т.д.), уменьшении притока крови к правому сердцу, а также при быстром и резком подъеме АД. В табл. 2.7 (глава 2) были представлены нормальные величины некоторых эхокардиографических показателей глобальной систолической функции ЛЖ. Напомним, что умеренно выраженная систолическая дисфункция ЛЖ сопровождается снижением ФВ до 40–45% и ниже, увеличением КСО и КДО (т.е. наличием умеренной дилатации ЛЖ) и сохранением в течение некоторого времени нормальных значений СИ (2,2–2,7 л/мин/м2). При выраженной систолической дисфункции ЛЖ происходит дальнейшее падение величины ФВ, еще большее увеличение КДО и КСО (выраженная миогенная дилатация ЛЖ) и уменьшение СИ до 2,2 л/мин/м2 и ниже. Диастолическая функция ЛЖ. Диастолическую функцию ЛЖ оценивают по результатам исследования трансмитрального диастолического кровотока в импульсном допплеровском режиме (подробнее см. главу 2). Определяют: 1) максимальную скорость раннего пика диастолического наполнения (Vmax Peak Е); 2) максимальную скорость трансмитрального кровотока во время систолы левого предсердия (Vmax Peak А); 3) площадь под кривой (интеграл скорости) раннего диастолического наполнения (MV VTI Peak Е) и 4) площадь под кривой позднего диастолического наполнения (MV VTI Peak А); 5) отношение максимальных скоростей (или интегралов скорости) раннего и позднего наполнения (Е/А); 6) время изоволюмического расслабления ЛЖ — IVRT (измеряется при одновременной регистрации аортального и трансмитрального кровотока в постоянно-волновом режиме из апикального доступа); 7) время замедления раннего диастолического наполнения (DT). Наиболее частыми причинами диастолической дисфункции ЛЖ у больных ИБС со стабильной стенокардией являются:
В большинстве случаев наблюдаются признаки диастолической дисфункции ЛЖ по типу “замедленной релаксации”, для которой характерно снижение скорости раннего диастолического наполнения желудочка и перераспределение диастолического наполнения в пользу предсердного компонента. При этом значительная часть диастолического кровотока осуществляется во время активной систолы ЛП. На допплерограммах трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение высоты пика А (рис. 2.57). Отношение Е/А уменьшается до 1,0 и ниже. Одновременно определяется увеличение времени изоволюмического расслабления ЛЖ (IVRT) до 90–100 мс и более и времени замедления раннего диастолического наполнения (DТ) — до 220 мс и более. Более выраженные изменения диастолической функции ЛЖ (“рестриктивный” тип) характеризуются значительным ускорением раннего диастолического наполнения желудочка (Peak Е) при одновременном уменьшении скорости кровотока во время систолы предсердия (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8 и более. Эти изменения сопровождаются укорочением фазы изоволюмического расслабления (IVRT) до значений меньше 80 мс и времени замедления раннего диастолического наполнения (DT) — меньше 150 мс. Напомним, что “рестриктивный” тип диастолической дисфункции, как правило, наблюдается при застойной СН или непосредственно предшествует ей, свидетельствуя о повышении давления наполнения и КДД ЛЖ. Оценка нарушений региональной сократимости левого желудочка Выявление локальных нарушений сократимости ЛЖ с помощью двухмерной эхокардиографии имеет важное значение для диагностики ИБС. Исследование обычно проводится из верхушечного доступа по длинной оси в проекции двух- и четырехкамерного сердца, а также из левого парастернального доступа по длинной и короткой оси. В соответствии с рекомендациями Американской ассоциации эхокардиографии ЛЖ при этом условно делится на 16 сегментов, располагающихся в плоскости трех поперечных сечений сердца, зарегистрированных из левого парастернального доступа по короткой оси (рис. 5.33). Изображение 6-ти базальных сегментов — переднего (А), переднеперегородочного (AS), заднеперегородочного (IS), заднего (I), заднебокового (IL) и переднебокового (AL) — получают при локации на уровне створок митрального клапана (SAX MV), а средних частей тех же 6-ти сегментов — на уровне папиллярных мышц (SAX PL). Изображения 4-х верхушечных сегментов — переднего (А), перегородочного (S), заднего (I) и бокового (L), — получают при локации из парастернального доступа на уровне верхушки сердца (SAX AP).
Общее представление о локальной сократимости этих сегментов хорошо дополняют три продольных “среза” ЛЖ, зарегистрированных из парастернального доступа по длинной оси сердца (рис. 5.34), а также в верхушечной позиции четырехкамерного и двухкамерного сердца (рис. 5.35).
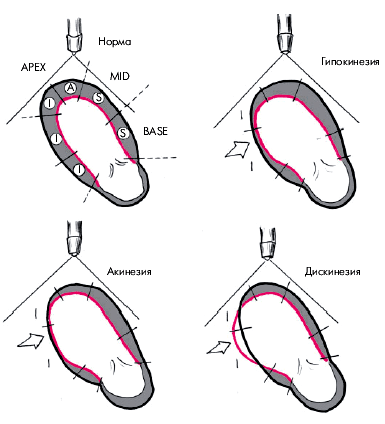
В каждом из этих сегментов оценивается характер и амплитуда движения миокарда, а также степень его систолического утолщения. Различают 3 вида локальных нарушений сократительной функции ЛЖ, объединяемых понятем “асинергия” (рис. 5.36): 1. Акинезия — отсутствие сокращения ограниченной области сердечной мышцы. 2. Гипокинезия — выраженное локальное уменьшение степени сокращения. 3.Дискинезия — парадоксальное расширение (выбухание) ограниченного участка сердечной мышцы во время систолы.
Причинами локальных нарушений сократимости миокарда ЛЖ у больных ИБС являются:
Следует также помнить, что локальные нарушения сократимости ЛЖ могут быть обнаружены не только при ИБС. Причинами таких нарушений могут быть:
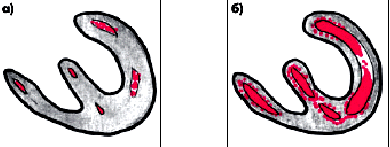
Наиболее выраженные нарушения локальной сократимости миокарда выявляют при остром ИМ и аневризме ЛЖ. Примеры этих нарушений приведены в главе 6. У больных со стабильной стенокардией напряжения, перенесших в прошлом ИМ, можно выявить эхокардиографические признаки крупноочагового или (реже) мелкоочагового постинфарктного кардиосклероза. Так, при крупноочаговом и трансмуральном постинфарктном кардиосклерозе двухмерная и даже одномерная ЭхоКГ, как правило, позволяет выявить локальные зоны гипокинезии или акинезии (рис. 5.37, а, б). Мелкоочаговый кардиосклероз или преходящая ишемия миокарда характеризуются появлением зон гипокинезии ЛЖ, которые чаще выявляются при переднеперегородочной локализации ишемического повреждения и реже — при его задней локализации. Нередко признаки мелкоочагового (интрамурального) постинфарктного кардиосклероза при эхокардиографическом исследовании не обнаруживаются.
Нарушения локальной сократимости отдельных сегментов ЛЖ у больных ИБС принято описывать по пятибалльной шкале: 1 балл — нормальная сократимость; 2 балла — умеренная гипокинезия (незначительное снижение амплитуды систолического движения и утолщения в исследуемой области); 3 балла — выраженная гипокинезия; 4 балла — акинезия (отсутствие движения и утолщения миокарда); 5 баллов — дискинезия (систолическое движение миокарда исследуемого сегмента происходит в направлении, противоположном нормальному). Для такой оценки, помимо традиционного визуального контроля, используется покадровый просмотр изображений, записанных на видеомагнитофоне. Важное прогностическое значение имеет расчет так называемого индекса локальной сократимости (ИЛС), который представляет собой сумму балльной оценки сократимости каждого сегмента (SS), деленную на общее число исследованных сегментов ЛЖ (n): ИЛС = ΣS / n . Высокие значения этого показателя у больных ИМ или постинфарктным кардиосклерозом нередко ассоциируются с повышенным риском летального исхода. Следует помнить, что при эхокардиографическом исследовании далеко не всегда удается добиться достаточно хорошей визуализации всех 16 сегментов. В этих случаях учитывают только те участки миокарда ЛЖ, которые хорошо выявляются при двухмерной эхокардиографии. Нередко в клинической практике ограничиваются оценкой локальной сократимости 6 сегментов ЛЖ: 1) межжелудочковой перегородки (верхней и нижней ее части); 2) верхушки; 3) переднебазального сегмента; 4) бокового сегмента; 5) заднедиафрагмального (нижнего) сегмента; 6) заднебазального сегмента. Стресс-эхокардиография. При хронических формах ИБС исследование локальной сократимости миокарда ЛЖ в покое далеко не всегда бывает информативным. Возможности ультразвукового метода исследования существенно расширяются при использовании метода стресс-эхокардиографии — регистрации нарушений локальной сократимости миокарда с помощью двухмерной эхокардиографии во время нагрузки. Чаще используют динамическую физическую нагрузку (тредмил или велоэргометрия в сидячем или лежачем положении), пробы с дипиридамолом, добутамином или чреспищеводную электростимуляцию сердца (ЧПЭС). Способы проведения нагрузочных тестов и критерии прекращения пробы не отличаются от таковых, используемых при классической электрокардиографии. Двухмерные эхокардиограммы регистрируют в горизонтальном положении пациента до начала исследования и сразу после окончания нагрузки (в течение 60–90 с). Для выявления нарушений локальной сократимости миокарда используют специальные компьютерные программы, позволяющие оценить степень изменения движения миокарда и его утолщения во время нагрузки (“стресса”) в 16 (или другом количестве) предварительно визуализированных сегментов ЛЖ. Результаты исследования практически не зависят от вида нагрузки, хотя более удобной является ЧПЭС и дипиридамоловая или добутаминовая пробы, поскольку все исследования проводятся в горизонтальном положении пациента. Чувствительность и специфичность стресс-эхокардиографии в диагностике ИБС достигает 80–90%. Главный недостаток этого метода состоит в том, что результаты исследования существенно зависят от квалификации специалиста, вручную устанавливающего границы эндокарда, которые в дальнейшем и используются для автоматического вычисления локальной сократимости отдельных сегментов. Исследование жизнеспособности миокарда.Эхокардиография, наряду со сцинтиграфией миокарда с 201Т1 и позитронной эмиссионной томографией, широко используется в последнее время для диагности жизнеспособности “гибернирующего” или “оглушенного” миокарда. С этой целью используют обычно добутаминовый тест. Поскольку даже малые дозы добутамина обладают выраженным положительным инотропным действием, сократимость жизнеспособного миокарда, как правило, возрастает, что сопровождается временным уменьшением или исчезновением эхокардиографических признаков локальной гипокинезии. Эти данные являются основанием для диагностики “гибернирующего” или “оглушенного” миокарда, что имеет важное прогностическое значение, в частности, для определения показаний к хирургическому лечению больных ИБС. Следует, правда, иметь в виду, что при более высоких дозах добутамина усугубляются признаки ишемии миокарда и сократимость вновь падает. Таким образом, при проведении добутаминового теста можно встретиться с двухфазной реакцией сократительного миокарда на введение положительного инотропного агента. Коронароангиография Коронароангиография (КАГ) — это метод рентгенологического исследования коронарных артерий сердца (КА) с помощью селективного заполнения венечных сосудов контрастным веществом. Являясь “золотым стандартом” в диагностике ИБС, коронароангиография позволяет определить характер, локализацию и степень атеросклеротического сужения КА, протяженность патологического процесса, состояние коллатерального кровообращения, а также выявить некоторые врожденные пороки развития венечных сосудов, например, аномальное отхождение КА или коронарный артериовенозный свищ. Кроме того, при выполнении КАГ, как правило, производят левую вентрикулографию, что дает возможность оценить ряд важных гемодинамических параметров (см. выше). Полученные при КАГ данные очень важны при выборе метода хирургической коррекции обструктивных поражений КА. Показания и противопоказания Показания.В соответствии с рекомендациямиЕвропейского общества кардиологов (1997) наиболее общими показаниями для проведения плановой КАГ являются уточнение характера, степени и локализации поражения КА и оценка нарушений сократительной способности ЛЖ (по данным левой вентрикулографии) у больных ИБС, подлежащих хирургическому лечению, в том числе:
В ряде случаев плановая КАГ показана также для верификации диагноза ИБС у больных с болями в области сердца и некоторыми другими симптомами, генез которых не удалось установить с помощью неинвазивных методов исследования, включая ЭКГ12, функциональные нагрузочные пробы, суточное мониторирование ЭКГ по Холтеру и т.п. Однако в этих случаях врач, направляющий такого пациента в специализированное учреждение для проведения КАГ, должен быть особенно осторожен и учитывать многие факторы, определяющие целесообразность этого исследования и риск его осложнений. Показания для проведения экстренной КАГ у больных острым коронарным синдромом представлены в главе 6 настоящего руководства. Противопоказания. Проведение КАГ противопоказано:
Методика исследования В настоящее время используют главным образом две методики КАГ. Наиболее часто применяется методика Джадкинса, при которой специальный катетер вводят путем чрескожной пункции в бедренную артерию, а затем ретроградно в аорту (рис. 5.38). В устье правой и левой КА вводят по 5–10 мл рентгеноконтрастного вещества и в нескольких проекциях осуществляют рентгеновскую кино- или видеосъемку, позволяющую получить динамические изображения коронарного русла. В тех случаях, когда у пациента имеется окклюзия обеих бедренных артерий, используют методику Соунса, при которой катетер вводят в обнаженную плечевую артерию.
К числу наиболее тяжелых осложнений, которые могут возникнуть при проведении КАГ, относятся: 1) нарушения ритма, в том числе желудочковая тахикардия и фибрилляция желудочков; 2) развитие острого ИМ; 3) внезапная смерть. Интерпретация результатов При анализе коронарограмм оценивают несколько признаков, достаточно полно характеризующих изменения коронарного русла при ИБС (Ю.С. Петросян и Л.С. Зингерман). 1. Анатомический тип кровоснабжения сердца: правый, левый, сбалансированный (равномерный). 2. Локализация поражений: а) ствол ЛКА; б) ПМЖВ ЛКА; в) ОВ ЛКА; г) передняя диагональная ветвь ЛКА; д) ПКА; е) краевая ветвь ПКА и другие ветви КА. 3. Распространенность поражения: а) локализованная форма (в проксимальной, средней или дистальной трети КА); б) диффузное поражение. 4. Степень сужения просвета: а. I степень — на 50%; б. II степень — от 50 до 75%; в. III степень — более 75%; г. IV степень — окклюзия КА. Левый анатомический тип характеризуется преобладанием кровоснабжения за счет ЛКА. Последняя участвует в васкуляризации всего ЛП и ЛЖ, всей МЖП, задней стенки ПП, большей части задней стенки ПЖ и части передней стенки ПЖ, прилежащей к МЖП. ПКА кровоснабжает при этом типе только часть передней стенки ПЖ, а также переднюю и боковую стенки ПП. При правом типе большая часть сердца (все ПП, большая часть передней и вся задняя стенка ПЖ, задние 2/3 МЖП, задняя стенка ЛЖ и ЛП, верхушка сердца) кровоснабжается за счет ПКА и ее ветвей. ЛКА при этом типе кровоснабжает переднюю и боковую стенки ЛЖ, переднюю треть МЖП, переднюю и боковую стенки ЛП. Чаще (примерно в 80–85% случаев) встречаются различные варианты сбалансированного (равномерного) типа кровоснабжения сердца, при котором ЛКА кровоснабжает все ЛП, переднюю, боковую и большую часть задней стенки ЛЖ, передние 2/3 МЖП и небольшую часть передней стенки ПЖ, прилегающую к МЖП. ПКА участвует в васкуляризации всего ПП, большей части передней и всей задней стенки ПЖ, задней трети МЖП и небольшой части задней стенки ЛЖ. Во время проведения селективной КАГ контрастное вещество последовательно вводится в ПКА (рис. 5.39) и в ЛКА (рис. 5.40), что позволяет получить картину коронарного кровоснабжения раздельно для бассейнов ПКА и ЛКА. У больных ИБС по данным КАГ наиболее часто выявляется атеросклеротическое сужение 2–3-х КА — ПМЖВ, ОВ и ПКА. Поражение этих сосудов имеет очень важное диагностическое и прогностическое значение, поскольку сопровождается возникновением ишемических повреждений значительных участков миокарда (рис. 5.41).
Степень сужения КА также имеет важное прогностическое значение. Гемодинамически значимым считают сужение просвета венечных артерий на 70% и больше. Стеноз КА до 50% расценивается как гемодинамически незначимый. Однако следует иметь в виду, что конкретные клинические проявления ИБС зависят не только от степени сужения КА, но и от многих других факторов, например, от степени развития коллатерального кровотока, состояния системы гемостаза, вегетативной регуляции сосудистого тонуса, склонности к спазму венечных артерий и др. Иными словами, даже при относительно малом сужении КА или при его отсутствии (по данным КАГ) при определенных обстоятельствах может развиться обширный острый ИМ. С другой стороны, нередки случаи, когда при хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может не сопровождаться возникновением ИМ. Оценка характера коллатерального кровообращения имеет, таким образом, важное диагностическое значение. Обычно при значительном и распространенном поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей (см. рис. 5.39), тогда как у больных с “коротким” ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося, как правило, возникновением распространенного и трансмурального некроза сердечной мышцы (например, у сравнительно молодых больных ИБС).
Левая вентрикулография Селективная ангиокардиография ЛЖ(левая вентрикулография) является частью протокола инвазивного исследования больных ИБС, направляемых на операцию реваскуляризации миокарда. Она дополняет результаты КАГ и позволяет провести количественную оценку органических и функциональных нарушений ЛЖ. С помощью левой вентрикулографии можно:
Локальные нарушения сократимости ЛЖявляются важным признаком очагового поражения миокарда, наиболее характерного для ИБС. Для выявления асинергий ЛЖ вентрикулограммы регистрируют во время систолы и диастолы, количественно оценивая амплитуду и характер движения стенки различных сегментов ЛЖ. На рис. 5.42 показан пример локального нарушения сократимости желудочка у больного ИБС. Наиболее частыми причинами “асинергий” ЛЖ у больных стабильной стенокардией напряжения являются рубцовые изменения сердечной мышцы после перенесенного ИМ, а также выраженная ишемия миокарда, в том числе “гибернирующий” и “оглушенный” миокард.
Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрированных в одной из проекций в конце систолы и диастолы. Методика расчета подробно описана в главе 6.
Лечение больных со стабильной стенокардией напряжения должно быть направлено на: 1. Устранение или уменьшение симптомов заболевания, в первую очередь, приступов стенокардии. 2. Повышение толерантности к физической нагрузке. 3. Улучшение прогноза заболевания и предупреждение возникновения нестабильной стенокардии, ИМ и внезапной смерти. Для достижения этих целей применяется комплекс лечебно-профилактических мероприятий, включающий немедикаментозное, медикаментозное и, при необходимости, хирургическое лечение и предусматривающий активное воздействие на основные звенья патогенеза ИБС:
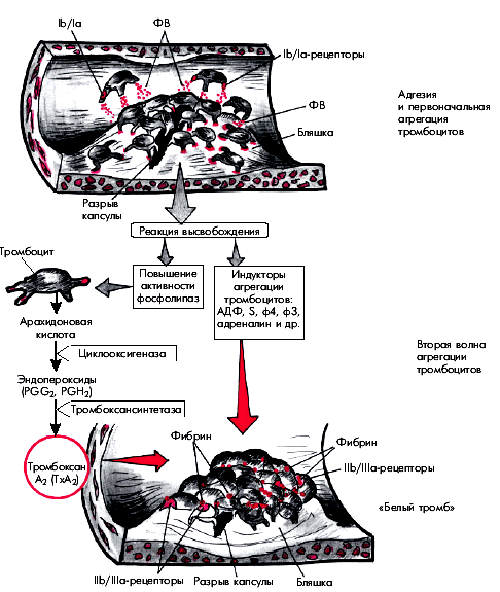
В настоящее время доказано положительное влияние большинства из перечисленных направлений и способов лечения на прогноз ИБС и частоту возникновения нестабильной стенокардии, ИМ и внезапной смерти. Антитромбоцитарная терапия Антитромбоцитарная терапия проводится с целью профилактики “обострений” ИБС, а также возникновения нестабильной стенокардии и ИМ. Она направлена на предотвращение пристеночного тромбообразования и, в известной степени, на сохранение целостности фиброзной оболочки атеросклеротической бляшки. Выше неоднократно упоминалось о том, что в основе “обострений” ИБС и возникновения нестабильной стенокардии (НС) или ИМ лежит разрыв атеросклеротической бляшки в КА с формированием на ее поверхности вначале тромбоцитарного (“белого”), а затем фибринного (“красного”) пристеночного тромба. Начальный этап этого процесса, связанный с адгезией и агрегацией тромбоцитов, подробно описан в разделе 5.2. Упрощенная схема этого процесса, протекающего на поверхности атеросклеротической бляшки, представлена на рис. 5.43.
Напомним, что в результате разрыва атеросклеротической бляшки обнажаются субэндотелиальные тканевые структуры и липидное ядро бляшек, содержимое которого попадает на поверхность разрыва и в просвет сосуда. Обнажившиеся компоненты соединительнотканного матрикса (коллаген, фактор Виллебранда, фибронектин, лиминин, витронектин и др.), а также детрит липидного ядра, содержащий тканевой тромбопластин, активируют тромбоциты. Последние с помощью гликопротеидных рецепторов (Iа, Ib), расположенных на поверхности тромбоцитов, и фактора Виллебранда прилипают (адгезируют) к поверхности поврежденной бляшки, образуя здесь монослой тромбоцитов, рыхло связанных с поврежденным эндотелием. Активированные и изменившие свою форму тромбоциты высвобождают индукторы последующей взрывной самоускоряющейся агрегации: АДФ, серотонин, фактор 3 и фактор 4 тромбоцитов, тромбоксан, адреналин и др. (“реакция высвобождения”). Одновременно активируется метаболизм арахидоновой кислоты и при участии ферментов циклооксигеназы и тромбоксансинтетазы образуется тромбоксан А2, который также обладает мощным агрегирующим, а также вазоконстрикторным действием. В результате возникает вторая волна агрегации тромбоцитов и образуется тромбоцитарный агрегат (“белый” тромб). Следует помнить, что в процессе этой стадии агрегации тромбоциты плотно связываются друг с другом с помощью молекул фибриногена, которые, взаимодействуя с рецепторами IIb/IIIа тромбоцитов, плотно “сшивают” кровяные пластинки между собой. Одновременно с помощью фактора Виллебранда тромбоциты прикрепляются к подлежащему субэндотелию. В дальнейшем активируется система коагуляции гемостаза и образуется фибринный тромб (см. главу 6). Таким образом, адгезия и агрегация тромбоцитов — это первый начальный этап тромбообразования, важнейшими звеньями которого являются:
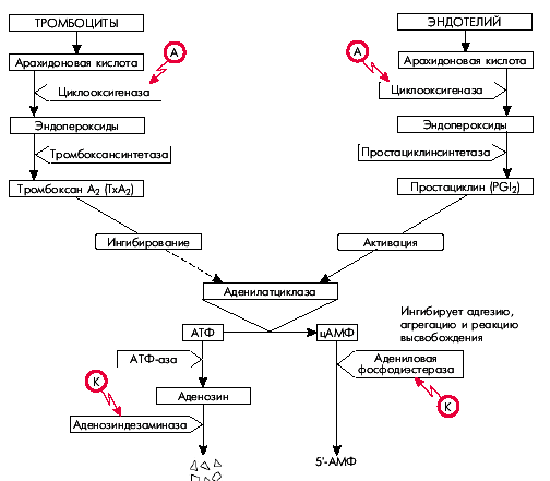
Как известно, арахидоновая кислота входит в состав клеточных мембран тромбоцитов и сосудистого эндотелия. Под действием фермента циклооксигеназы она переходит в эндопероксиды. В дальнейшем в тромбоцитах под действием тромбоксансинтетазы эндопероксиды превращаются в тромбоксан А2, являющийся мощным индуктором дальнейшей агрегации тромбоцитов и одновременно обладающий вазоконстрикторным действием (рис. 5.44).
В сосудистом эндотелии пероксиды превращаются в простациклин, отличающийся противоположными эффектами: он ингибирует агрегацию тромбоцитов и обладает дилатирующими свойствами. Действие тромбоксана А2 (ТхА2) и простациклина на агрегацию тромбоцитов реализуется благодаря их различному влиянию на аденилатциклазу, под действием которой АТФ превращается в цАМФ: тромбоксан А2 ингибирует это превращение, а простациклин — активирует. Следует помнить, что высокие концентрации цАМФ угнетают агрегацию тромбоцитов, тогда как уменьшение концентрации, наоборот, способствует агрегации. Именно поэтому простациклин, активирующий аденилатциклазу и увеличивающий содержание цАМФ, ингибирует адгезию, агрегацию и реакцию высвобождения тромбоцитов, а тромбоксан А2, наоборот, угнетая аденилатциклазу, замедляет переход АТФ в цАМФ. В результате уменьшается концентрация цАМФ, что способствует усилению адгезии и агрегации тромбоцитов. С практической точки зрения большое значение имеют также дальнейшие превращения цАМФ и АТФ (см. рис. 5.44): цАМФ инактивируется (уменьшая свою концентрацию в клетке) адениловой фосфодиэстеразой. АТФ “распадается” под действием АТФ-азы на фосфорную кислоту и аденозин, инактивация которых осуществляется под действием аденозиндезаминазы. При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы приводит к снижению концентрации аденозина и преобладанию вазоконстрикторных эффектов.
Описанные схемы тромбоцитарно-сосудистого гемостаза, а также метаболизма арахидоновой кислоты следует учитывать при назначении тех или иных ЛС, обладающих антитромбоцитарным эффектом. В настоящее время наиболее широкое распространение в клинической практике получили следующие антитромбоцитарные препараты:
Аспирин (ацетилсалициловая кислота) Более 20 лет аспирин является одним из основных ЛС для лечения и профилактики ИБС. Механизм антиагрегантного действия аспирина обусловлен ингибированием фермента циклооксигеназы (см. рис. 5.44). При этом следует иметь в виду, что ингибирование циклооксигеназы тромбоцитов сопровождается уменьшением образования тромбоксана А2 и, следовательно, уменьшением агрегации тромбоцитов и вазоконстрикторного действия тромбоксана. Наоборот, угнетение циклооксигеназы сосудистого эндотелия приводит к уменьшению образования простациклина, что способствует уменьшению его вазодилатирующего и антиагрегантного действия. Важно помнить, что циклооксигеназа тромбоцитов чувствительна даже к малым дозам аспирина (75–325 мг в сутки), тогда как нежелательное угнетение образования простациклина происходит только при сравнительно высоких суточных дозах этого ЛС. Поэтому больным ИБС рекомендуют обычно прием малых доз препарата, не превышающих 75–325 мг в сутки. Действие аспирина на циклооксигеназу тромбоцитов необратимо и эффект препарата сохраняется на протяжении всей жизни тромбоцита, т.е. в течение 8–10 дней. По данным международного многоцентрового широкомасштабного исследования (Second International Study of Infarct Survival, ISIS-2, 1990), применение аспирина снижало летальность больных от сердечно-сосудистых причин на 23% по сравнению с плацебо. Применение аспирина у больных ИБС и АГ уменьшало частоту летальных и нелетальных ИМ на 36%, а летальность от коронарных осложнений — на 15% (широкомасштабное исследование Hypertension Optimal Treatment, HOT, включавшее 26 000 пациентов). Характерно, что эффективность малых (менее 160 мг в сутки), средних (160–325 мг в сутки) и высоких (500–1500 мг в сутки) доз аспирина оказалась примерно одинаковой. Это позволяет рекомендовать аспирин в суточной дозе 160–325 мг в сутки для лечения больных ИБС. Обычно используют дозы 100–325 мг в сутки. Более высокие дозы препарата угнетают выработку простациклина и приводят к росту числа побочных эффектов. Лечение аспирином должно проводиться длительно (практически в течение всей жизни больного). Побочные эффекты. При использовании малых доз препарата серьезные побочные эффекты, требующие отмены препарата, развиваются сравнительно редко. В то же время следует учитывать возможность возникновения следующих нежелательных явлений:
Риск возникновения побочных эффектов при приеме аспирина можно уменьшить, если использовать минимальные дозы препарата или его новые лекарственные формы (напpимер, аспирин-кардио). Противопоказания. Назначение аспирина противопоказано в следующих случаях:
С осторожностью следует применять аспирин у больных, страдающих бронхиальной астмой, при неконтролируемой АГ, при одновременной терапии антикоагулянтами, при наличии язвенной болезни желудка и двенадцатиперстной кишки в анамнезе, в первом и втором триместрах беременности. Тиклопидин Тиклопидин (тиклид) является производным тиенопиридина и обладает отчетливыми антитромбоцитарными свойствами. Под действием тиклопидина блокируются АДФ-рецепторы тромбоцитов, подавляется адгезия кровяных пластинок, а также уменьшается связывание фибриногена с IIb/IIIа рецепторами тромбоцитов на заключительном этапе агрегации (см. рис. 5.43). Хотя эффект тиклопидина сопоставим с таковым аспирина, а по некоторым данным (исследования CATS и TASS) превышает его, он редко применяется для длительного лечения больных ИБС, в частности, в связи с возможными побочными явлениями в виде развития нейтропении, панцитопении и повышения содержания ЛНП и ЛОНП. Тиклопидин используют, в основном, в кардиохирургической практике в виде коротких (до 1–2 месяцев) курсов антитромбоцитарной терапии после операции аортокоронарного шунтирования или чрескожной транслюминальной баллонной ангиоплатстики. Препарат назначают в дозе 500 мг в сутки в 2 приема. Терапевтический эффект наступает только через 3–5 дней после начала лечения и сохраняется в течение10 дней после отмены препарата. При применении тиклопидина необходим контроль анализа крови каждые 2 недели, по крайней мере, в течение первых 3-х месяцев лечения. Побочные эффекты при приеме тиклопидина:
Противопоказания.Прием тиклопидина противопоказан в следующих клинических ситуациях:
Клопидогрель Клопидогрель (плавикс) также является производным тиенопиридина и по механизму действия мало отличается от тиклопидина. Его эффективность выше, а риск возникновения нейтропении, тромбоцитопении, панцитопении, геморрагий и диспептических расстройств меньше, чем у тиклопидина. Препарат принимают в дозе 75 мг в сутки (однократно). Побочные эффекты и противопоказания к применению те же, что и у тиклопидина. Курантил (дипиридамол) Курантил (дипиридамол) является высокоэффективным антитромбоцитарным препаратом, обладающим выраженными вазодилатирующими свойствами. Его эффект связан с конкурентным ингибированием адениловой фосфодиэстеразы (см. рис. 5.44) и, соответственно, с повышением содержания цАМФ в тромбоцитах, что способствует снижению их способности к агрегации. Кроме того, препарат угнетает активность аденозиндезаминазы, что приводит к увеличению содержания аденозина — эффективного вазодилатирующего биологического агента. Это объясняет наличие выраженного вазодилатирующего эффекта, проявляющегося преимущественно на уровне резистивных сосудов (артериол). Имеются данные о положительном влиянии курантила на эндотелиальную функцию. Такое сочетание делает препарат незаменимым при длительном лечении больных со стабильной стенокардией. С этой целью курантил назначают в дозе 225 мг в сутки (по 75 мг 3 раза в день). Следует помнить, что теофиллин и некоторые пищевые продукты, содержащие производные ксантинов (кофе, крепкий чай и т.д.), являясь антагонистами курантила, значительно снижают его эффективность. По данным некоторых широкомасштабных плацебоконтролируемых исследований, длительный прием курантила в дозе 225 мг в сутки позволяет на 24–30% снизить число ИМ и внезапной сердечной смерти и на 15% — уровня смертности от всех сердечно-сосудистых заболеваний. Таким образом, терапевтический эффект курантила вполне сопоставим с эффектом аспирина, но число геморрагических осложнений существенно меньше, чем при приеме аспирина. Побочные эффекты. Нежелательные эффекты при длительном приеме курантила встречаются относительно редко, в основном при назначении дозы препарата, превышающей 200 мг в сутки, и связаны главным образом с вазодилатирующим эффектом курантила: головные боли, головокружения, шум в ушах, гиперемия кожи лица, небольшая тахикардия. Возможны также диспептические явления (тошнота, диарея, боли в эпигастральной области). Противопоказания. Прием курантила противопоказан в следующих клинических ситуациях:
Антиангинальные средства Антиангинальные (антиишемические) ЛС — это препараты, обладающие свойством предупреждать или купировать приступы стенокардии и уменьшать другие проявления преходящей ишемии миокарда. Это основная группа ЛС, которые используются для лечения больных ИБС со стабильной стенокардией напряжения. Действие всех антиангинальных ЛС при ИБС основано на гемодинамической разгрузке миокарда и изменении соотношения потребления миокардом кислорода и реальным коронарным кровообращением. В клинической практике обычно используют 3 группы антиангинальных ЛС: 1. Нитраты и молсидомин. 2. β-адреноблокаторы. 3. Блокаторы медленных кальциевых каналов (антагонисты кальция). Нитраты и молсидомин Нитраты являются в настоящее время основными ЛС, которые используются для купирования и профилактики приступов стенокардии. Впервые эта уникальная способность нитроглицерина была продемонстрирована W. Murrel в 1879 г. Механизм действия нитратов на гладкомышечные клетки сосудистой стенки тесно связан с функцией эндотелия (см. главу 1 и раздел 5.2). Напомним, что в сосудах здорового человека любое воздейстие на эндотелий (увеличение напряжения сдвига при ускорении кровотока, повышение уровня АД, агрегация тромбоцитов и т.п.) вызывает эндотелийзависимую релаксацию сосуда, в основе которой лежит усиленная продукция расслабляющих факторов, в первую очередь, оксида азота (NO). Последний не только предотвращает сосудистый спазм, но и вместе с простациклином ингибирует процесс адгезии и агрегации тромбоцитов, выполняя, таким образом, важную защитную роль, участвуя в регуляции местного сосудистого тонуса и процесса пристеночной агрегации тромбоцитов. Выше неоднократно указывалось, что у больных ИБС резко снижена продукция эндотелиального расслабляющего фактора (NО) и других дилатирующих факторов и, наоборот, повышена продукция вазоконстрикторных субстанций. Это один из главных факторов, способствующих нарушению коронарного кровотока и прогрессированию заболевания. Органические нитраты (эфиры фосфорной кислоты) при парентеральном введении или сублингвальном применении быстро проникают внутрь сосудистого эндотелия и гладкомышечной клетки, являясь источником экзогенного оксида азота (NО). Включаясь таким образом в клеточный метаболизм, они обеспечивают релаксацию сосудов и в известной степени угнетают процесс агрегации тромбоцитов (рис. 5.45). Характерно, что для внутриклеточного превращения органических нитратов в оксид азота (NО) требуются соединения, содержащие сульфгидрильные (SH) группы (цистеин).
Под действием нитратов происходит также умеренная дилатация артерий и артериол, снижение ОПСС и величины постнагрузки. Однако этот эффект достигается, как правило, при более высоких концентрациях нитратов, чем при венодилатирующем эффекте: максимальное расширение вен происходит уже после сублингвального применения 0,1–0,2 мг нитроглицерина, тогда как расширение артериол — при приеме 0,4–0,6 мг нитроглицерина (В.Г. Кукес). Непосредственное коронарорасширяющее действие нитратов в дозах, используемых в клинике, выражено незначительно и не имеет определяющего значения в формировании антиангинального действия (П.Х. Джанашия с соавт.). Тем не менее прием нитратов закономерно сопровождается увеличением коронарного кровотока. Это происходит преимущественно за счет уменьшения КДО и КДД ЛЖ, что сопровождается уменьшением диастолического напряжения стенки желудочка, увеличением градиента давления и, соответственно, величины коронарного кровотока (рис. 5.47).
Только в тех случаях, когда имеется выраженное повышение тонуса КА (спазм), нитроглицерин и другие нитраты способны активно воздействовать на стенку крупной КА в месте ее сужения (динамического стеноза). Этот эффект приобретает особенно важное значение у больных вазоспастической стенокардией Принцметала. Следует также помнить, что нитраты обладают умеренно выраженным антитромбоцитарным действием. Классификация нитратов. Для лечения больных ИБС в настоящее время широко используются три группы нитратов:
Известно большое количество препаратов, относящихся к этим группам, а также их лекарственных форм, отличающихся способом применения, эффективностью и продолжительностью антиангинального действия. С практической точки зрения целесообразно условное деление всех нитратов и их лекарственных форм в зависимости от продолжительности их действия (В.И. Метелица, В.П. Лупанов, С.Ю. Марцевич и др.): 1. Нитраты короткого действия (длительность эффекта до 1 ч). 2. Нитраты умеренно пролонгированного действия (длительность эффекта от 1 ч до 6 ч). 3. Нитраты значительно пролонгированного действия (длительность эффекта от 6 ч до 24 ч). Механизм действия всех нитратов практически одинаков. Они отличаются в основном по своим фармакокинетическим свойствам и, соответственно, по биодоступности, величине и скорости наступления антиангинального эффекта, продолжительности действия и некоторым другим параметрам (табл. 5.7). Таблица 5.7 Основные характеристики антиангинального действия нитратов и молсидомина
Препараты нитроглицерина — это, в основном, короткодействующие средства, используемые для купирования приступов стенокардии, хотя буккальные формы нитроглицерина (полимерные биорастворимые пластинки, которые накладывают на верхнюю десну), мазевые формы и пластыри с нитроглицерином, отличающиеся большей продолжительностью действия (3–5 ч и больше), могут применяться с целью профилактики стенокардии. Популярные в прошлом таблетки депо-нитроглицерина, содержащие микрокапсулы с активным веществом, постепенно растворяющиеся в кишечнике (сустак-форте, нитронг-форте), отличаются весьма умеренным антиангинальным эффектом. Отчасти это связано с тем, что бульшая часть нитроглицерина при энтеральном способе введения (около 80–90%) инактивируется ферментными системами печени и в системный кровоток попадает лишь малая часть принятой внутрь дозы препарата. Следует также напомнить, что антиангинальное действие препаратов депо-нитроглицерина, содержащих от 2,5 мг до 5 мг активного вещества (сустак-мите, нитронг-мите и др.), не отличается от эффекта плацебо. Поэтому эти препараты вообще не должны использоваться для лечения больных ИБС. Препараты изосорбида динитрата (ИДН) являются одними из самых распространенных в нашей стране антиангинальных ЛС (нитросорбид, изо мак, изодинит, изокет, кардикет и многие другие). При приеме внутрь они практически полностью абсорбируются в кишечнике, однако в системный кровоток попадает всего 10–20% изосорбида динитрата. Остальная часть элиминируется в печени. Правда, при деградации изосорбида динитрата образуются его активные метаболиты, в том числе изосорбид-5-мононитрат, который обладает самостоятельными вазодилатирующими свойствами и в настоящее время с успехом применяется для лечения больных ИБС (см. ниже). Лечение препаратами изосорбида динитрата рекомендуют начинать с разовой дозы 10 мг, которая по эффективности сопоставима с действием сустака-форте или нитронга-форте. Поэтому после некоторого периода применения препарата в дозе 10 мг следует перевести больного на прием более эффективных разовых доз, например, обычных таблеток ИДН 20 мг или таблеток ИДН-ретард 40 мг. Продолжительность действия этих ЛС колеблется от 3–4 ч (разовая доза 10 мг) до 4–6 ч (ретардные таблетки 40 мг). В последние годы иногда используются две ретардные формы изосорбида динитрата, которые содержат 60 мг и 120 мг активного вещества. Продолжительность их антиангинального эффекта достигает 12–15 ч. Препараты изосорбида-5-мононитрата (имдур, оликард, эфокс-лонг, моночинкве, моно мак-депо и др.), синтезированные в последние годы, находят все большее распространение в клинической практике. Они отличаются существенными преимуществами, особенно заметными при лечении тяжелых больных со стенокардией напряжения III–IV ФК. В отличие от других нитратов, препараты изосорбида 5-мононитрата (ИМН) не подвергаются разрушению в печени и, следовательно, отличаются высокой биоусвояемостью (около 90%) и продолжительным действием (см. табл. 5.7). Эффект этих препаратов является более стабильным и предсказуемым, чем изосорбида динитрата (П.Х. Джанашия с соавт.). Продолжительность антиангинального действия обычных таблеток изосорбида-5-мононитрата (10 мг, 20 мг и 40 мг) примерно на 1,5–2 ч больше, чем у аналогичных препаратов изосорбида динитрата, а у ретардных форм (таблетки по 50–100 мг) достигает 10–12 ч и даже 24 ч. Препараты особенно хорошо переносятся больными, редко приводя к побочным явлениям. Благодаря своим положительным свойствам, препараты изосорбида 5-мононитрата с успехом применяются в лечении тяжелых больных ИБС со стенокардией III–IV ФК. Молсидомин, отличаясь по своей химической структуре от нитратов, почти полностью идентичен им по механизму антиангинального действия. В печени молсидомин трансформируется в активный метаболит SIN–1А, который выделяет оксид азота (NО), что, как известно, сопровождается отчетливым вазодилатирующим и умеренным антиагрегантным эффектом (см. рис. 5.45). Характерно, что в отличие от органических нитратов, молсидомин стимулирует образование оксида азота без участия SH-групп. Это объясняет, по-видимому, тот факт, что при лечении молсидомином гораздо реже, чем при применении нитратов, развивается толерантность. Препараты молсидомина (корватон и сиднофарм) отличаются умеренно пролонгированным действием (около 4–6 ч) и поэтому могут использоваться для профилактики приступов стенокардии. Противопоказания. Абсолютными противопоказаниями к использованию нитратов являются:
С осторожностью следует применять нитраты в следующих клинических ситуациях (относительные противопоказания):
Тактика лечения нитратами и молсидомином Купирование приступа стенокардии Для купирования приступа стенокардии обычно используют короткодействующие лекарственные формы нитроглицерина и изосорбида динитрата. Наиболее популярным способом купирования стенокардии является сублингвальный прием таблетки нитроглицерина(0,5 мг). Его купирующий эффект наступает, как правило, в течение 1–3 мин, естественно, при условии прекращения действия любых факторов, спровоцировавших приступ стенокардии (например, физической нагрузки). Максимальный эффект наступает через 5–6 мин, а общая продолжительность действия при таком способе применения нитроглицерина не превышает 10–20 мин. При отсутствии эффекта через 5 мин можно повторить прием препарата. Сублингвальное применение нитр
Поиск по сайту: |



 Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза.
Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза.