 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Морфологічна організація посмугованого м’язаСтр 1 из 3Следующая ⇒
РОЗДІЛ 17. БІОХІМІЯ М’ЯЗОВОЇ ТКАНИНИ
М’язова тканина становить 40 – 42 % усієї маси тіла людини. Біохімічні процеси, що перебігають у м’язах, чинять суттєвий вплив на організм людини в цілому. Основна функція м’язів – механічний рух, в якому хімічна енергія перетворюється на механічну за умов постійного тиску та температури. Розрізняють три типи м’язової тканини: скелетну (посмуговану), гладку (непосмуговану) та серцеву, яка морфологічно теж належить до посмугованої мускулатури, але за низкою інших ознак займає проміжне місце між гладкими та посмугованими м’язами.
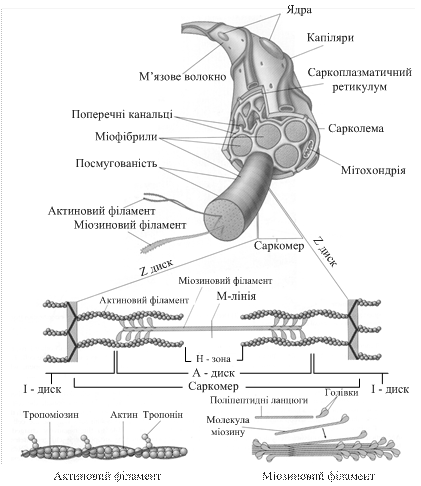
Морфологічна організація посмугованого м’яза Посмугований м’яз складається з численних волокон або м’язових клітин. Рухові еферентні нерви входять у м’язове волокно і через нервово-м’язовий синапс викликають скорочення. М’язове волокно розглядають як багатоядерну клітину великих розмірів, вкриту еластичною оболонкою – сарколемою (рис.17.1). Діаметр функціонально зрілого посмугованого м’язового волокна становить 10 – 100 мкм, а його довжина часто відповідає довжині всього м’яза. Виділяють білі та червоні м’язові волокна. Білі відрізняються вищим вмістом міофібрил і, відповідно до цього, здатністю до швидших, але короткочасних скорочень. У них багато глікогену, висока активність ферментів гліколізу, креатинфосфокінази, міокінази. У червоних волокнах вміст міофібрил менший, а в саркоплазмі більший. Вони мають хороше кровопостачання, багато мітохондрій, високу активність ферментів окислювального фосфоритування і призначені для роботи в аеробних умовах. Свою назву червоні волокна одержали через наявність у них високого вмісту міоглобіну. Ці волокна відрізняються вираженим тонічним характером скорочення і слугують для підтримання тіла в певному положенні (поза, постава). У людини білі та червоні волокна зустрічаються разом в одному і тому ж м’язі, проте «білі» волокна переважають у м’язах-розгиначах, а «червоні» - у м’язах спини. У кожному м’язовому волокні в саркоплазмі по довжині волокна розташовані, нерідко у формі пучків, міофібрили (товщина їх менше 1 мкм), які мають, як і все волокно в цілому, поперечну посмугованість. Тут також знаходиться і низка інших структур: мітохондрії, мікросоми, рибосоми, трубочки і цистерни саркоплазматичного ретикулуму, різноманітні вакуолі, гранули глікогену і включення ліпідів, які відіграють роль запасних енергетичних матеріалів тощо. Повторюваним елементом посмугованої міофібрили є саркомер – ділянка міофібрили, межами якої служать вузькі Z-лінії. Кожна міофібрила складається з декількох сотень саркомерів, середня довжина кожного становить 2,5 – 3,0 мкм. Усередині саркомера знаходиться зона довжиною 1,6 – 5 мкм, темна у фазово-контрастному мікроскопі. У поляризованому світлі вона дає подвійну променезаломлюваність. Цю зону прийнято називати диском А (анізотропний диск). У центрі диска А розташована лінія М, яку можна спостерігати тільки в електронному мікроскопі. Середню частину диска А займає зона Н слабшої подвійної променезаломлюваності. Нарешті, існують ізотропні диски або диски I, із дуже слабкою подвійною променезаломлюваністю. У фазово-контрастному мікроскопі вони світліші ніж диски А. Довжина дисків I близько 1 мкм. Кожен із них розділений на дві половини Z-мембраною, або Z-лінією.
Рис.17.1. Структура волокна скелетного м’яза
Відповідно до сучасних уявлень, у дисках А розташовані товсті нитки, які складаються, основним чином, із білка міозину, і тонкі нитки, що містять білок F-актин, тропоміозин і тропонін. Тонкі нитки беруть свій початок у межах кожного саркомера в Z-лінії, тягнуться через диск I, проникають у диск А і перериваються в ділянці зони Н. Товсті нитки діаметром 12 – 16 нм і довжиною приблизно 1,5 мкм вкладені в формі шестикутника діаметром 40 – 50 нм і пронизують весь диск А. Між ними розташовані тонкі нитки діаметром 8 нм, вони простягаються від Z-лінії на відстань біля 1 мкм. У стані скорочення диски I майже зникають, а зона перекривання товстих і тонких ниток збільшується (у скелетному м’язі в стані скорочення саркомер вкорочується до 1,7 – 1,8 мкм). Відповідно до моделі, запропонованої Е.Хакслі і Р.Нідергерке, під час скорочення міофібрил одні нитки ковзають відносно інших, що і є причиною м’язового скорочення. Хімічний склад м’яза 17.2.1. Особливості хімічного складу скелетного м’яза. У м’язовій тканині людини міститься 72 – 80 % води, решта припадає на сухий залишок, який в основному представлений білками, а також вуглеводами (здебільшого глікогеном), різноманітними ліпідами, екстрактивними азотовмісними речовинами тощо. (табл. 17.1).
Таблиця 17.1. Хімічний склад посмугованого м’яза ссавців (середні значення)
М’язові білки. Білки м’язової тканини поділяють на три основні групи: саркоплазматичні (біля 35 % від усієї кількості білків м’язів), міофібрилярні (45 %) і білки строми (20 %). Білки, що входять до складу саркоплазми, належать до протеїнів, розчинних у сольових середовищах. Це міоглобін і різноманітні білки-ферменти, які локалізовані, основним чином, у мітохондріях і каталізують процеси тканинного дихання (окисного фосфорилування), а також реакції азотного і ліпідного обмінів. Нещодавно була відкрита група саркоплазматичних білків, які можуть зв’язувати іони Са2+, їхня фізіологічна роль достеменно не з’ясована. До групи міофібрилярних білків належать міозин, актин та актоміозин (розчинні в сольових середовищах) і так звані регуляторні білки: тропоміозин, тропонін, a-актинін. Білки строми в представлені, в основному, колагеном і еластином. Зупинимося детальніше на характеристиці міофібрилярних білків, оскільки вони тісно пов’язані зі скорочувальною функцією м’язів. Міозинстановить 50 – 55 % від сухої маси міофібрил. Уявлення про міозин, як про основний білок міофібрил, склалося в результаті робіт А.Я.Данилевського, О.Фюрта, Е.Вебера і інших вчених, проте загальну увагу до міозину було привернуто лише після опублікування робіт В.А.Енгельгардта і М.Н.Любимова, у яких автори показали, що міозин проявляє АТФ-азну активність, тобто здатність каталізувати розщеплення АТФ на АДФ і Н3РО4. Хімічна енергія, що при цьому вивільняється, перетворюється на механічну енергію м’язового скорочення. Міозин – олігомерний білок з молекулярною масою 500 000 Да, який складається з 6 субодиниць попарно однакових: дві тяжких субодиниці (молекулярна маса 200 000 да) та чотири легких (молекулярна маса 15 000 – 27 000 да). Тяжкі ланцюги з боку С-кінця утворюють довгу закручену a-спіраль (“хвіст” молекули), а з боку N-кінця – глобулу (“голівку”), здатну з’єднуватися з актином. Ці “голівки” випинаються з основного стержня молекули. При з’єднанні двох тяжких ланцюгів С-кінцевими ділянками утворюється суперспіраль. Легкі ланцюги гетерогенні за своїм складом, входять до складу глобули міозинової молекули і беруть участь у прояві АТФазної активності міозину. Стрижнева ділянка суперспіралі має два відділи, де спіралі оголені – ці місця відкриті для дії протеолітичних ферментів і мають посилену рухливість. Короткочасна обробка трипсином розщеплює молекулу міозину на два фрагменти. З хвостової ділянки (С-кінцевої ділянки молекули) утвориться легкий мероміозин (ЛММ) – фрагмент довжиною 90 нм, а з “голівки” – тяжкий мероміозин (ТММ). ЛММ, подібно до міозину утворює нитки, але він не володіє АТФазною активністю і не зв’язує актин. ТММ каталізує гідроліз АТФ і зв’язує актин, при його подальшій обробці трипсином або папаїном можна отримати один фрагмент довжиною 40 нм з молекулярною масою 62 000 Да і два фрагменти з молекулярною масою 110 000 Да, вони слугували “голівками” міозину. Актин становить 20 % від сухої маси міофібрил. Був відкритий Ф.Штраубом у 1942 р. Відомі дві форми актину: глобулярний актин (G-актин) з молекулярною масою 42 000 Да, який складається з одного поліпептидного ланцюга (глобули), в утворенні якого беруть участь 374 амінокислотних залишки, і фібрилярний актин (F-актин), який утворюється при спонтанній агрегації G-актину і на електронних мікрофотографіях має вигляд двох ниток намиста, закручених одна навколо іншої (суперспіраль). Слугує алостеричним активатором міозину. a-Актинін – білок, який локалізується у зоні Z-лінії. До нього приєднуються кінці F-актинових молекул тонких філаментів. при з’єднанні міозину з F-актином утворюється актоміозин. Він володіє АТФазною активністю, активується іонами Мg2+, а інгібується – етилендиамінтетраацетатом (ЕДТА) і високою концентрацією АТФ. Тропоміозин був відкритий К.Бейлі в 1946 р. Молекула тропоміозину з молекулярною масою 65 000 Да складається з двох ланцюгів і має вигляд спіралі, довжина якої 40 нм. У тонких нитках на 1 молекулу тропоміозину припадає 7 молекул G-актину. Розташовується тропоміозин в жолобі між двома спіралями G-актину і закриває активні центри зв’язування актину (рис. 17.2).
Тн-Т відповідає за зв’язування тропоніну з тропоміозином, через нього конфірмаційні зміни тропоніну передаються на тропоміозин. Тропонін, з’єднуючись з тропоміозином, утворює комплекс, названий нативним тропоміозином. Цей комплекс прикріплюється до актинових філаментів і надає актоміозину скелетних м’язів чутливість до іонів Са2+. Тн-С – це Са2+-зв’язуюча субодиниця, яка містить 4 ділянки для зв’язування кальцію. За своєю будовою схожа на кальмодулін. Тн-І – інгібіторна субодиниця, вона створює просторову перешкоду, яка запобігає взаємодії актину та міозину в момент, коли Тн-С не зв’язаний з іонами кальцію. Встановлено, що тропонін (його субодиниці Тн-Т і Тн-І) може фосфорилуватися за участі цАМФ-залежних протеїнкіназ. Питання про те, чи має відношення це фосфорилування до регуляції м’язового скорочення, залишається поки що не з’ясованим Небілкові азотисті екстрактивні речовини. У скелетних м’язах. Як вказано в таблиці 17.1, міститься низка азотистих екстрактивних речовин: аденілові нуклеотиди (АТФ, АДФ і АМФ), нуклеотиди неаденілового ряду, креатинфосфат, креатин, креатинін, карнозин, ансерин, вільні амінокислоти тощо.
Серед вільних амінокислот у м’язах найвища концентрація глутамінової кислоти (до 1,2 г/кг) і її аміду – глутаміну (0,8 – 1,0 г/кг). Інші азотовмісні речовини: сечовина, сечова кислота, аденін, гуанін, ксантин і гіпоксантин зустрічаються в м’язовій тканині в невеликій кількості і, зазвичай, є проміжними або кінцевими продуктами азотистого обміну. До складу клітинних мембран м’язової тканини входить низка фосфогліцеридів: фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин тощо. фосфогліцериди також беруть участь в обмінних процесах, зокрема, слугують субстратами тканинного дихання. Безазотисті речовини. Одним з основних представників безазотистих органічних речовин м’язової тканини є глікоген. Його концентрація коливається від 0,3 до 2 % і вище. У м’язах містяться лише сліди вільної глюкози і дуже мало гексозофосфатів. У процесі метаболізму глюкози та амінокислот у м’язовій тканині утворюються молочна, піровиноградна кислоти і багато інших карбонових кислот. У тій або іншій кількості в м’язовій тканині виявляють також тригліцериди та холестерин. З неорганічних речовин переважають катіони калій і натрій (калій зосереджений, основним чином, всередині м’язових волокон, а натрій ― у міжклітинній речовині), присутні також мікроелементи: кобальт, алюміній, нікель, бор, цинк тощо. 17.2.2. Особливості хімічного складу міокарда та гладких м’язів.Міокард за вмістом низки хімічних сполук займає проміжне місце між скелетними та гладкими м’язами. У ньому, так само як і в гладких м’язах, мало міофібрилярних білків, проте значно більше міоальбуміну порівняно зі скелетним м’язом. Вміст АТФ у серцевому м’язі становить 2,6 мкмоль/г тканини, що значно нижче порівняно зі скелетним м’язом (4,43 мкмоль/г тканини) і вище порівняно з гладким (1,38 мкмоль/г тканини). За вмістом глікогену міокард теж займає проміжне місце, але порівняно з іншими видами м’язової тканини в ньому найбільше фосфогліцеринів, під час окиснення яких, очевидно, утворюється значна частина енергії, необхідна для скорочення.
Поиск по сайту: |
 Тропонін – глобулярний білок, відкритий С.Ебасі в 1963 р., його молекулярна маса 80 000. У скелетних м’язах дорослої людини тропонін (Тн) становить лише приблизно 2 % від усіх міофібрилярних білків і розташовується на тропоміозині з однаковими проміжками, довжина яких рівна довжині молекули тропоміозину (рис. 17.2). Тропонін складається з трьох субодиниць (Тн-І, Тн-С, Тн-Т).
Тропонін – глобулярний білок, відкритий С.Ебасі в 1963 р., його молекулярна маса 80 000. У скелетних м’язах дорослої людини тропонін (Тн) становить лише приблизно 2 % від усіх міофібрилярних білків і розташовується на тропоміозині з однаковими проміжками, довжина яких рівна довжині молекули тропоміозину (рис. 17.2). Тропонін складається з трьох субодиниць (Тн-І, Тн-С, Тн-Т).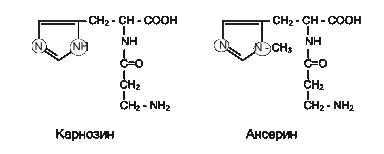 Важливе значення для функціональної активності м’язової тканини належить дипептидам карнозину та ансерину – специфичним азотистим речовинам скелетної мускулатури хребетних. Вони збільшують амплітуду м’язового скорочення. Попередньо знижену втомленням. Роботами акад. С.Е.Северіна показано, що дипептиди, які містять імідазол, не впливають безпосередньо на скорочувальний апарат, але збільшують ефективність роботи іонних помп м’язової клітини.
Важливе значення для функціональної активності м’язової тканини належить дипептидам карнозину та ансерину – специфичним азотистим речовинам скелетної мускулатури хребетних. Вони збільшують амплітуду м’язового скорочення. Попередньо знижену втомленням. Роботами акад. С.Е.Северіна показано, що дипептиди, які містять імідазол, не впливають безпосередньо на скорочувальний апарат, але збільшують ефективність роботи іонних помп м’язової клітини.