|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
НЕСПЕЦИФИЧЕСКИЙ ЯЗВЕННЫЙ КОЛИТ
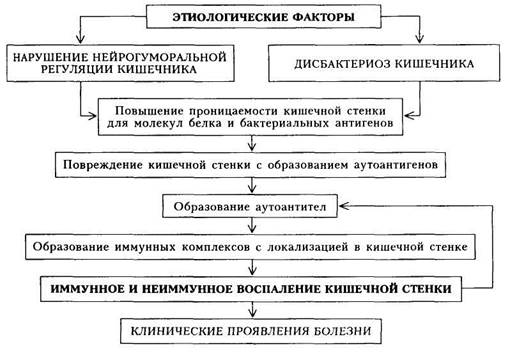
Неспецифический язвенный колит (НЯК) — некротизиру-ющее воспаление слизистой оболочки прямой и ободочной кишки неизвестной этиологии. В ранней стадии колит проявляется нарушением целостности эпителия и сосудистой реакцией, позднее присоединяются изъязвления слизистой оболочки, не распространяющиеся глубоко в стенку кишки. В выраженной стадии слизистая оболочка отечна, с многочисленными небольшими или обширными язвами неправильной формы. В слизистой оболочке развиваются псевдополипы, что связано с изъязвлением ее и регенерацией эпителия. При хронизации процесса репаративно-склеро-тические изменения начинают преобладать, происходит рубцевание язв, образуются обширные зоны рубцовой ткани, приводящие к резкой деформации и укорочению кишки, просвет ее сужается. НЯК болеют люди всех возрастных групп (чаще в возрасте 20 — 40 лет), женщины болеют в 1,5 раза чаще мужчин, болезнь у них протекает тяжелее, а смертность — в 2 раза выше, чем у мужчин. Этиология.Точных сведений о причине развития болезни в настоящее время нет. Придают значение инфекционным факторам, в том числе дисбактериозу, воздействию протеолитических и муколитических ферментов, пищевой и бактериальной аллергии. Патогенез.Основными патогенетическими механизмами являются изменение иммунологической реактивности, дисбактериоз и своеобразие нервно-вегетативных реакций организма (схема 18). Дисбактериоз и, в частности, увеличение количества Escherichia и Yersinia оказывают местное токсическое и аллергизирующее влияние. Особенности нервно-вегетативных реакций вызывают дисфункцию вегетативной и гормональной регуляции, а также изменение проницаемости слизистой оболочки толстой кишки. В результате облегчается проникновение веществ, обладающих антигенными свойствами. Известно, что антигены некоторых штаммов Escherichia coli индуцируют синтез антител к ткани кишечника. Цитопатогенное действие противотолстокишечных антител сочетается с действием протеолитических и иных продуктов метаболизма микрофлоры кишечника и вызывает иммунное и неиммунное воспаление стенки кишечника. Иммунные механизмы обусловливают вовлечение в патологический процесс других органов и систем (внекишечные поражения), к которым относятся поражения кожи, органа зрения, полости рта, опорно-двигательного аппарата, системы крови. Классификация.В настоящее время общепринятой классификации НЯК нет. Для практических целей выделяют три основные формы: ост-
рую, хроническую и рецидивирующую [Юхвидова Ж.М., Левитан М.Х., 1966]. В пределах каждой клинической формы встречаются легкие, сред-нетяжелые и тяжелые варианты течения болезни. Острая, или молниеносная, форма встречается редко, отличается тяжестью общих и местных проявлений, ранним развитием осложнений. Процесс развивается бурно, как правило, захватывает всю толстую кишку. Хроническая форма характеризуется непрерывным, длительным, истощающим течением, с постепенным нарастанием симптоматики. Рецидивирующая форма встречается наиболее часто. Для нее характерны ремиссии продолжительностью от 3 — 6 мес и более, сменяющиеся обострениями различной выраженности. Одна клиническая форма может переходить в другую. При НЯК тяжесть заболевания обусловлена степенью вовлечения в патологический процесс отделов толстой кишки. Наиболее часто наблюдается проктосигмоидит (67 %), тотальный колит встречается у 16 % больных, изолированный проктит — у 5 %. Клиническая картина.Проявления болезни обусловлены обширностью и выраженностью поражения толстой кишки и внекишечными проявлениями, однако на первом месте стоят «кишечные» симптомы. На I этапе диагностического поиска выявляют жалобы на диарею, жидкий или кашицеобразный стул, наличие в нем крови, слизи и гноя. Выделяют несколько вариантов начала заболевания. • Постепенное появление поноса; через несколько дней в жидких ис • Болезнь дебютирует ректальными кровотечениями при оформлен • Появление диареи с кровью и слизью, болью, интоксикацией. При развернутой картине болезни дискинетический и язвенно-геморрагический синдромы проявляются в виде частого жидкого стула с примесью крови и гноя, иногда слизи, что является основным симптомом. Стул до 20 раз в сутки, а при тяжелом течении число дефекаций достигает 40 и более, преимущественно ночью и утром. Больные тяжелой формой НЯК нередко страдают недержанием кала, что связано с поражением наружного сфинктера заднего прохода и общей слабостью. Примесь крови в стуле бывает значительной, иногда выделения из толстой кишки состоят из одной крови. В период обострения больные в день теряют 100 — 300 мл крови. Количество слизи в испражнениях зависит от сохранности слизистой оболочки кишки. При тотальном глубоком поражении слизистой оболочки слизь в испражнениях отсутствует. В период обострения испражнения представляют собой зловонную гнойно-слизистую жидкость с примесью крови. Во время ремиссии понос может полностью прекратиться, но чаще стул кашицеобразный, 3 — 4 раза в день, с незначительным включением слизи и крови. Обязательный симптом тотального НЯК — схваткообразные боли. Больные не всегда могут точно определить локализацию боли, лишь приблизительно указывая зону основного поражения. Чаще всего это область сигмовидной ободочной и прямой кишки, реже — область пупка и слепой кишки. Типичным является усиление болей перед дефекацией и ослабление после опорожнения кишечника. Прием пищи также усиливает боль и диарею, так что иногда больные отказываются от еды. Поражение прямой и сигмовидной ободочной кишки приводит к те-незмам. Позывы на дефекацию носят резко императивный характер. Больные нередко отмечают чувство неполного опорожнения прямой кишки. При неспецифическом язвенном проктите и проктосигмоидите некоторые больные отмечают запоры по 2 — 3 дня, чередование поноса с запорами, которые носят спастический характер. Практически все больные жалуются на слабость, похудание. В период ремиссии состояние улучшается, увеличивается масса тела. С каждым рецидивом слабость и похудание прогрессируют. При проктите и проктосигмоидите масса тела обычно не снижается, аппетит сохранен, слабость умеренная. При молниеносной форме бурно нарастают явления интоксикации: тошнота, рвота, высокая температура тела, слабость вплоть до адинамии. Похудание быстро достигает степени кахексии. Развиваются синдром органных поражений и астеноневротическии синдром в виде резкого изменения психики (больные становятся обидчивыми, плаксивыми, утрачивают чувство юмора). Неэффективность противодизентерийной терапии в дебюте, дальнейшее прогрессирование заболевания, вовлечение других органов и систем позволяют заподозрить тяжелое поражение кишечника, в том числе НЯК, опухоль, туберкулез и т.д. На II этапе диагностического поиска выявляют клинические признаки дистрофически-анемического и дискинетического синдромов, местных и системных осложнений. При остром течении и тотальном поражении кишечника больные впадают в прострацию, истощены, обезвожены. Наблюдается сухость кожи и слизистых оболочек, резко снижен тургор. Кожные покровы бледные, температура тела 39 — 40 °С и выше. Отмечаются тахикардия, артериальная гипотензия, уменьшение диуреза. Печень и селезенка нередко увеличены. Пальпируется болезненная урчащая толстая кишка с уплотненными стенками. Кожа вокруг заднего прохода мацерирована, слизистая оболочка прямой кишки пролабирует. Острая форма часто сопровождается осложнениями. Наибольшую опасность представляет перфорация, возможны множественные перфорации. Перфорации, возникшие на фоне тяжелой интоксикации, резких болей в животе, часто протекают атипично, без бурного начала, без острых болей. Не сразу возникает мышечная защита. В связи с этим наличие перфорации можно предполагать на основании только общего ухудшения состояния больного в сочетании с учащением пульса, падением АД. Для острой токсической дилатации толстой кишки характерны резкое расширение и вздутие отдельных сегментов, чаще поперечной ободочной кишки. Участок кишки резко растягивается жидкостью и газами, что может закончиться прободением и перитонитом. При этом осложнении частота дефекации уменьшается, стул теряет каловый характер, увеличивается выделение крови, гноя и слизи. Определяются высокая лихорадка, значительная тахикардия, коллапс. Живот вздут, пальпация по ходу вздутых участков толстой кишки резко болезненна. Перистальтика вялая или отсутствует. При хронической форме НЯК в клинической картине преобладают проявления гиповитаминоза, анемии, эндокринных расстройств (дистрофически-анемический синдром). На II этапе выявляется также ряд патологических изменений других органов и систем (синдром органных поражений). Типичным проявлением кожных изменений НЯК является узловатая эритема: появляются единичные или множественные узлы, чаще на разгибательной поверхности голеней. При тяжелых формах болезни встречаются гангренозная пиодермия и массивные изъязвления кожи нижних конечностей. Для тяжелых форм НЯК характерны также поражение слизистой оболочки рта, афтозный стоматит, глоссит и гингивит. Обычно отмечается изъязвление края или нижней поверхности языка, реже десен. Боли при приеме пищи настолько сильны, что больные отказываются от пищи. Возможен язвенный эзофагит. При НЯК могут возникать ириты, конъюнктивиты и блефариты. Отмечается четкая зависимость выраженности глазных симптомов от формы и фазы болезни. НЯК может осложниться полиартритом. Обычно поражаются голеностопные и коленные суставы с небольшим ограничением движений и нерезкими болями. Артриты возникают одновременно с НЯК и исчезают при ремиссии, не оставляя деформации. У некоторых больных развиваются спондилиты. Сравнительно часто НЯК осложняется сужением просвета кишки, что проявляется картиной толстокишечной непроходимости. При пальцевом исследовании прямой кишки можно выявить осложнения, которые при НЯК возникают часто (перианальные абсцессы, анальные трещины, парапроктит, флегмона клетчатки параректального пространства, прямокишечные и ректовагинальные свищи). На III этапе выявление характерных изменений слизистой оболочки толстой кишки позволяет поставить окончательный диагноз. Для постановки диагноза НЯК (с учетом постоянного поражения прямой кишки) достаточно ректороманоскопии. В начале болезни слизистая оболочка гиперемирована, отечна, покрыта слизью, под которой отмечается «зернистость» с точечными и мелкими изъязвлениями. Позднее под слизистой оболочкой образуются характерные просовидные абсцессы; после их вскрытия остаются мелкие язвы, которые в дальнейшем сливаются. При тяжелой острой форме возможно полное разрушение слизистой оболочки и глубжележащих слоев; внутренняя поверхность становится более гладкой, стенка хрупкой, легко рвется. Стиханию клинических проявлений соответствует эндоскопическая картина в виде частичной эпителизации, уменьшения размеров язв, появления псевдополипов. В период ремиссии происходит полная эпителиза-ция, слизистая оболочка гладкая, со стертым сосудистым рисунком, могут выявляться мелкие псевдополипы. Для определения степени и характера поражения толстой кишки, выявления ряда осложнений следует проводить ирригоскопию. Рентгенологическая картина в ранние стадии НЯК при неглубоких морфологических изменениях скудна и неспецифична. После длительного лечения при рентгенологическом исследовании выявляются отсутствие га-устрации, ригидность, равномерные атрофия и сужение кишки, ее укорочение. Кишка имеет вид водопроводной трубы. В фазу обострения можно выявить изменение рельефа: широкие поперечные валики с краевыми зубцами, псевдополипоз. Этот метод может обнаружить стриктуру кишки и возможную малигнизацию. При токсической дилатации толстой кишки в связи с опасностью ир-ригоскопии (провокация перфорации) диагностическое значение приобретает обзорная рентгенография: на снимках видны растянутые (от 10 см и более) сегменты кишки. При подозрении на перфорацию следует чаще прибегать к обзорной рентгеноскопии брюшной полости для обнаружения «свободного» газа. Фиброколоноскопия позволяет точно определить характер изменений на всем протяжении толстой кишки, а также выявить поражение илеоце-кального клапана (баугиниева заслонка) и терминального отдела тонкой кишки. При хроническом течении НЯК и в фазе ремиссии в диагностике помогают эндомикроскопическое исследование и биопсия слизистой оболочки. Лабораторное исследование крови позволяет определять степень и характер анемий. При массивном кишечном кровотечении возникает острая постгеморрагическая анемия. Постоянная ежедневная, даже «скрытая» кровопотеря также приводит к дефициту железа в организме и развитию анемии. У некоторых больных развивается приобретенная аутоиммунная гемолитическая анемия (с положительной реакцией Кумбса, ретикулоцито-зом и неконъюгированной гипербилирубинемией). При тотальном НЯК с вовлечением тонкой кишки возникает дефицит фолиевой кислоты и витамина В12, в генезе которого определенную роль играет дисбактериоз. Для острого НЯК и рецидивов характерны повышение СОЭ и небольшой лейкоцитоз со сдвигом лейкоцитарной формулы влево. Важным является определение СОЭ в динамике, так как количество лейкоцитов часто остается нормальным даже в тяжелых случаях, что связывают с гипокор-тицизмом и приемом сульфаниламидов. Нечасто возникающий высокий лейкоцитоз почти всегда является сигналом тяжелого осложнения. Биохимическое исследование крови помогает установить степень нарушения белкового и электролитного обмена, а также выявить поражение печени и почек. Копрологическое исследование отражает степень воспалительно-деструктивного процесса. Микроскопически обнаруживают скопления лейкоцитов, эритроциты, большие скопления клеток кишечного эпителия. Резко положительная реакция на растворимый белок в кале (проба Трибу-ле) свидетельствует также о воспалении кишечной стенки. Бактериологическое исследование кала в дебюте НЯК помогает исключить острую дизентерию. Определение характера и степени дисбакте-риоза необходимо для проведения антибактериальной терапии. Показательными для нарушенного биоценоза кишечника являются количественные сдвиги облигатной микрофлоры: отсутствие роста бифидобактерий в разведении 107 и резкое изменение количества кишечной палочки. Дисбактериоз проявляется также высоким представительством кишечной палочки со слабовыраженными ферментативными свойствами (более 10 %), лактозонегативных энтеробактерий (более 5 %), появлением микроорганизмов рода протея, грибов рода кандида, гемолизирующих эшерихий, стафилококка. Диагностика.Распознавание неспецифического язвенного колита основывается на выявлении следующих признаков: 1) «характерных» изменений стула: частый, неоформленный стул с 2) патологических изменений при копрологическом исследовании: 3) «специфических» изменений слизистой оболочки: контактная кро 4) «типичных» изменений кишки при ирригоскопии: укорочение, су На основании данных, полученных на всех трех этапах диагностического поиска, выработаны критерии тяжести НЯК (табл. 12). Дифференциальная диагностика.В силу того что клиническая картина НЯК сходна с проявлениями других поражений кишечника, его приходится дифференцировать от ряда заболеваний. Прежде всего НЯК дифференцируют от острой диареи. НЯК протекает тяжелее, быстро возникают осложнения, введение антибиотиков не улучшает состояния, как при бактериальной дизентерии, а усугубляет его. При бактериальной дизентерии в отличие от НЯК ректороманоскопия не выявляет обширных язвенных полей, диффузной кровоточивости, псевдо-полипоза. Таблица 12. Клинико-лабораторные критерии тяжести неспецифического язвенного колита
НЯК следует дифференцировать также от болезни Крона (терминальный илеит), при которой отмечаются боли в илеоцекальной области, понос, сменяющийся запорами (без примеси крови), лихорадка, анемия. Поперечная и нисходящая ободочная кишка интактны, поэтому не наблюдается поносов и выраженных кровотечений. В ряде случаев в патологический процесс вовлекается сигмовидная, ободочная и прямая кишка, и тогда дифференцировать НЯК можно только по данным эндоскопического исследования, а также микроскопии биоптата слизистой оболочки. При хронических формах НЯК, когда ведущими симптомами являются кашицеобразный стул и выделение крови из прямой кишки, дифференциальную диагностику проводят с новообразованием прямой и толстой кишки, хроническим колитом. Окончательный диагноз ставят с учетом результатов эндоскопии. Формулировка развернутого клинического диагнозастроится по следующей схеме: 1) клиническая форма; 2) степень вовлечения отделов толстой кишки; 3) степень тяжести; 4) фаза заболевания; 5) осложнения. Лечение.Объем лечебных мероприятий зависит от тяжести течения болезни, фазы (обострение или ремиссия) и наличия или отсутствия осложнений. Комплексное лечение предусматривает борьбу с воспалительным процессом, воздействие на моторику и микрофлору кишечника, коррекцию обменных нарушений, создание психического и физического покоя. Общие мероприятия включают диету и психотерапию. Пища должна быть достаточно калорийной и включать 110—120 г/сут белка, в период обострения больного переводят на диету № 4, при стихании обострения пища может быть непротертой. Больной не требует каких-либо особых ограничений в питании. Однако некоторые больные не переносят определенные продукты, которые следует исключить из рациона. Психотерапия чрезвычайно важна. Большая роль принадлежит доверительным взаимоотношениям врача и больного. При необходимости назначают седативные препараты (валериана, корвалол или валокордин) или психотропные средства (сибазон, или седуксен, или валиум, феназе-пам, нозепам, или тазепам, и пр.). Больные с тяжелым течением болезни нуждаются в неотложной госпитализации и строгом постельном режиме. Назначают парентеральное питание (путем катетеризации подключичной вены вводят различные растворы — аминопептид, альвезин, липофундин, или интралипид, глюкозу вместе с электролитами и витаминами комплекса В). Из противовоспалительных препаратов (если нет показаний к хирургическому лечению) назначают глюкокортикоиды, в особенности если одновременно имеются внекишечные проявления болезни. Преднизолон вначале вводят внутривенно (в дозе, эквивалентной 40 мг преднизолона), а затем переходят на прием внутрь; при достижении эффекта дозу постепенно снижают. Для борьбы с патогенной флорой кишечника назначают антибиотики (ампициллин по 6 г/сут, канамицин по 2 г/сут или гентами-цин по 2 мг/кг в сутки) или фуразолидон по 0,1 г 4 раза в день. В дальнейшем для нормализации флоры добавляют бифидумбактерин или лакто-бактерин (по б доз 2 раза в день в течение 20 дней). При НЯК средней тяжести в периоде обострения больные также госпитализируются. Кроме соответствующей диеты, они получают противовоспалительную терапию — преднизолон 40 мг/сут и сульфасалазин в клизмах (1—3 г/сут в виде неразведенной суспензии). При наступлении ремиссии дозу преднизолона уменьшают и одновременно назначают сала-зосульфапиридин, или сульфасалазин (вначале 1 г/сут, повышая затем до 2 г/сут, а в дальнейшем и до 4 г/сут, если нет побочных реакций). Обычно преднизолон в дозе 40 мг/сут принимают в течение месяца, а затем постепенно снижают в течение 2 — 4 мес, дозу сульфасалазина при этом снижают до 2 г/сут. Одновременно проводят лечение имеющегося дисбактериоза. При НЯК легкого течения показан прием сульфасалазина по 3 — 6 г/сут или по 1,5 — 2 г ректально (в виде клизм). В фазе ремиссии, для которой характерно отсутствие жалоб, лихорадки, анемии и других патологических показателей, обычно назначают на длительное время прием сульфасалазина по 2 г/сут без существенных ограничений в диете. Если рентгенологические, эндоскопические данные нормальны в течение длительного времени (не менее 2 лет), то можно на несколько месяцев полностью отменить прием сульфасалазина. В периоды обострения или же при сохранении ряда симптомов в периоде улучшения состояния при частом стуле используют антидиарейные препараты — реасек (ломотил) по 20 — 30 мг в день, желательно сочетание его с м-холинолитиками и спазмолитиками; следует применять также вяжущие средства (отвар коры дуба, плодов черники, черемухи). При болях применяют м-холинолитики и спазмолитики (папаверин, но-шпа, галидор). Противорецидивная терапия состоит в следующем: • соблюдение диеты № 46 или 4в (механически щадящая с исключе • прием сульфасалазина по 1 г 2 раза в день в течение 1 мес; • нормализация моторики кишечника; • диспансерное наблюдение: контроль клинического анализа крови Лицам с длительностью НЯК более 10 лет 1 — 2 раза в год следует проводить колоноскопию (опасность малигнизации). Борьба с осложнениями включает в себя консервативное лечение острой токсической дилатации толстой кишки. Для этого необходимо ограничить прием пищи и полностью отменить холинолитики и опиаты. Требуется полноценная коррекция электролитного обмена, особенно калиевого, а также восполнение потери жидкости и белка. Проводят гемо-трансфузии, как правило, прямое переливание крови. Назначают антибиотики широкого спектра действия. Осторожно проводится декомпрессия желудка с помощью зонда. Клизмы противопоказаны. Необходимо соблюдать осторожность с газоотводной трубкой (опасность спазма и перфорации сигмовидной ободочной кишки). При неэффективности консервативных мероприятий проводится тотальная колэктомия с наложением илеостомы (одномоментно). В случае перфорации толстой кишки ушивание не производится. Показана геми- или тотальная колэктомия с наложением илеостомы. Показаниями к оперативному лечению являются: • обоснованное подозрение на перфорацию; • острая токсическая дилатация толстой кишки, не поддающаяся те • профузное кишечное кровотечение; • неэффективность комплексной интенсивной терапии при острой тя • неэффективность комплексной терапии рецидивирующего НЯК; • развитие стриктур с явлениями частичной кишечной непроходи • малигнизация. У больных с илеостомой в дальнейшем необходимо стремиться к осуществлению реконструктивных и восстановительных операций (илеорек-тальный анастомоз, создание искусственной ампулы и т.д.). Прогноз.Прогноз при НЯК зависит от клинической формы заболевания, распространенности процесса и тяжести его течения. При тяжелом течении НЯК прогноз неблагоприятный вследствие развития различных осложнений. Комплексная терапия может смягчить проявления болезни, однако полной и длительной ремиссии обычно не наступает. Профилактика.Специфические профилактические меры неизвестны. Профилактика сводится к предупреждению обострений, что достигается упорным лечением. Больных ставят на диспансерный учет, чтобы своевременно выявить начинающееся обострение или осложнение. БОЛЕЗНЬ КРОНА Болезнь Крона (БК) — хроническое прогрессирующее гранулема-тозное воспаление кишечника. Чаще всего патологический процесс поражает тонкую кишку (в 45 % — поражается илеоцекальная область, в 30 % — ее проксимальный отдел), толстая кишка поражается реже — в 25 % случаев. В 5 % случаев болезнь может дебютировать с поражением пищевода или желудка, или двенадцатиперстной кишки, или перианальной области. Воспалительный процесс распространяется на всю толщу кишечной стенки и характеризуется наличием инфильтратов с изъязвлением слизистой оболочки, развитием абсцессов и свищей с последующим рубцевани- ем и сужением просвета кишки. Протяженность поражения пищеварительного тракта при Б К весьма различна: от 3 — 5 см до 1 ми более. Точные сведения о распространенности Б К среди населения отсутствуют. Отмечено, что Б К страдают чаще люди трудоспособного возраста (20 — 50 лет) обоего пола. Этиология.Причины развития болезни неизвестны. Предполагают этиологическую роль бактерий, вирусов, пищевых аллергенов, генетических факторов (семейный характер болезни отмечен в 5 % случаев). Отмечено, что БК ассоциируется с антигеном гистосовместимости HLA-B27- Патогенез.Точные представления о механизмах развития болезни отсутствуют. Отмечено, что кишечной микрофлоре принадлежит важная роль, так как при Б К выявляются значительные нарушения микробиоценоза кишечника. Характерно уменьшение количества бифидобактерий при одновременном увеличении числа энтеробактерий и появление энтеробактерий с признаками патогенности. Возможно, что в патогенезе имеют значение и аутоиммунные механизмы. Предполагают, что органами иммуногенеза вырабатываются аутоантитела к клеткам слизистой оболочки кишечника, а также сенсибилизированные лимфоциты, обладающие повреждающим действием. Воспалительный процесс при БК начинается в подслизистом слое и распространяется на все слои кишечной стенки. В подслизистом слое на фоне диффузной инфильтрации лимфоцитами и плазматическими клетками отмечается гиперплазия лимфоидных фолликулов, которые могут изъязвляться. Язвы при БК имеют удлиненную щелевидную форму и глубоко проникают в подслизистый и мышечные слои, образуя свищи и абсцессы. Наличие свищей, стриктур и кишечного стаза способствует развитию дис-бактериоза. Распространенное поражение тонкой кишки вызывает тяжелый синдром нарушения всасывания (мальабсорбция). Снижение всасывания железа, витамина В)2 и фолиевой кислоты вызывает анемию, чему способствуют и повторные кровопотери. Возникновение воспалительного процесса и изъязвлений в кишечнике приводит также к интоксикации, профузным поносам, потере массы тела, нарушениям электролитного обмена. Клиническая картина.Клинические проявления и характер течения заболевания определяются тяжестью морфологических изменений, анатомической локализацией и протяженностью патологического процесса, наличием осложнений и внекишечных поражений. К проявлению собственно кишечных поражений относят боль в животе, диарею, синдром недостаточного всасывания, поражения аноректаль-ной области (свищи, трещины, абсцессы), ректальные кровотечения (редко). К внекишечным признакам относят лихорадку, анемию, снижение массы тела, артрит, узловатую эритему, афтозный стоматит, поражения глаз (ирит, увеит, эписклерит), вторичную аменорею у женщин. Однако, несмотря на значительную вариабельность клинических проявлений при БК, в 90 % случаев доминируют боль в животе, диарея, снижение массы тела. На I этапе диагностического поиска, при наиболее часто встречающейся хронической форме БК, выявляется диарея, имеющая упорный характер. Частота стула достигает 4 — 6 раз (редко — до 10 раз), масса испражнений — более 200 г/сут, кал разжиженный или водянистый. Диарея возникает после каждого приема пищи, но может быть и ночью. Объем стула зависит от локализации патологического процесса в кишечнике: при поражении высоких отделов тонкой кишки объем кала оказывается большим, нежели при дистальной локализации воспалительного процесса. Тенезмы отмечаются лишь при вовлечении в процесс аноректальной области. Ректальные кровотечения, обычно необильные, отмечаются у половины больных. Боли в животе бывают практически у всех больных, они носят чаще тупой или схваткообразный характер (при поражении толстой кишки). Максимальная выраженность болей отмечается при вовлечении в процесс тонкой кишки. Причины болей разнообразны: а) вовлечение в патологический процесс брюшины; б) повышение давления в просвете кишки в результате повышенного газообразования и увеличения объема кишечного содержимого вследствие нарушения всасывания; в) наличие осложнений (частичная кишечная непроходимость, свищи, абсцессы). В период обострения отмечается лихорадка, сочетающаяся с общей слабостью и уменьшением массы тела. Температура тела может повышаться до 39 °С. В ряде случаев повышение температуры «опережает» местные кишечные симптомы, такая ситуация может продолжаться в течение длительного времени, что создает большие диагностические трудности. Другое частое внекишечное проявление болезни — артралгии в крупных суставах. Таким образом, при сборе анамнеза выявляются кишечные симптомы и системные (внекишечные) проявления. Эти признаки не позволяют еще сформулировать определенную диагностическую концепцию, однако направление диагностического поиска можно определить. Гораздо сложнее, когда в клинической картине доминируют «общие» признаки (лихорадка, уменьшение массы тела, артралгии, артрит). На II этапе диагностического поиска уточняются симптомы со стороны желудочно-кишечного тракта в виде болезненности при пальпации живота (преимущественно вокруг пупка), урчания, болезненного уплотнения терминального отдела подвздошной кишки, болезненности, урчания и «шума плеска» при пальпации слепой кишки. Отмечается уменьшение массы тела, особенно при длительном течении болезни. Снижение массы тела обусловлено прежде всего синдромом нарушенного всасывания. Синдром нарушенного всасывания имеет сложный патогенез и обусловлен рядом факторов: а) уменьшением всасывающей поверхности кишки из-за воспалительного процесса слизистой оболочки; 6) дефицитом кишечных ферментов (дисахаридазы, лактазы); в) снижением активности панкреатических ферментов; г) нарушением всасывания желчных кислот, что приводит к блокированию всасывания воды и электролитов. Кроме того, снижение массы тела связано с уменьшением приема пищи вследствие ано-рексии (особенно в период обострения болезни). В 25 % случаев можно обнаружить перианальные поражения: отек кожи вокруг анального сфинктера, трещины и изъязвления сфинктера, свищи и периректальные абсцессы. При этом наружные анальные поражения превалируют над поражением слизистой оболочки прямой кишки в отличие от неспецифического язвенного колита (НЯК), при котором эти соотношения обратные. При осмотре могут быть выявлены внекишечные проявления в виде артрита крупных суставов (дефигурация сустава), узловатой эритемы, поражения глаз. При тяжелом течении болезни и выраженном синдроме нарушенного всасывания отмечаются симптомы гиповитаминоза и дефицита железа: сухость кожи, выпадение волос, ломкость ногтей, хейлит, глоссит, кровоточивость десен. На III этапе диагностического поиска необходимо убедиться в характере и обширности поражения кишечника, а также оценить выраженность обменных расстройств и внекишечных поражений. Для постановки окончательного диагноза прежде всего необходимо сделать эндоскопию (колоноскопию), позволяющую осмотреть слизистую оболочку всей толстой кишки и терминального отдела подвздошной. Выявляется отечность слизистой оболочки, исчезновение сосудистого рисунка, небольшие афтозные язвы с последующим образованием глубоких ще-левидных трещин, изменяющих рельеф слизистой оболочки по типу «булыжной мостовой», возможно появление стриктур кишки. Биопсия слизистой оболочки кишки выявляет характерные морфологические изменения в виде гранулем туберкулоидного и саркоидного типов. Аналогичные изменения слизистой оболочки выявляются и при гастродуоденоскопии (в случаях поражения верхних отделов желудочно-кишечного тракта). Рентгенологическое исследование кишечника (ирригоскопия, энтеро-скопия) в выраженных случаях болезни демонстрирует сегментарность поражения кишечника с наличием неизмененных участков кишки между пораженными сегментами. В области поражения отмечают волнистый или неровный контур кишки, продольные язвы, образующие рельеф «булыжной мостовой», псевдодивертикулы (представляющие собой глубокие язвы, проникающие в результате фиброзных изменений в кишечной стенке — «симптом шнура»). Лабораторное исследование крови позволяет определить степень и характер анемии (железодефицитная, В^-дефицитная). Для рецидива болезни характерны повышение СОЭ, иногда достигающее значительных величин (50 — 60 мм/ч). Биохимическое исследование крови отражает нарушения белкового, жирового и электролитного обмена (гипоальбуминемия, гиполипидемия, гипогликемия, гипокальциемия), обусловленные выраженностью синдрома нарушенного всасывания. Для выявления нарушения всасывания используют также тест с D-ксилозой и витамином В12 (тест Шиллинга). Более детально на этих тестах мы останавливались при описании хронического энтерита. Анализ кала предусматривает микроскопию, химическое и бактериологическое исследование. Недостаточность переваривания и всасывания в тонкой кишке проявляется большим количеством мышечных волокон, значительным количеством жирных кислот и мыл; определяется небольшое количество соединительной ткани, нейтрального жира и йодофильной флоры. Степень изменений копрограммы обусловливается тяжестью болезни и ее фазой (ремиссия — обострение). При вовлечении в патологический процесс других органов системы пищеварения (печень, желчные пути, поджелудочная железа) лаборатор-но-инструментальным исследованием можно обнаружить соответствующие изменения. Осложнения.Большинство осложнений БК являются хирургической проблемой: кишечная непроходимость, перфорация кишки с развитием абсцессов и перитонита, кишечные кровотечения, формирование энтеро-энтеральных, кишечно-кожных, кишечно-пузырных и ректовагинальных свищей. Диагностика.Распознавание болезни в развитой форме при наличии типичных кишечных симптомов не представляет сложностей. Однако достаточно часто возникают ситуации, когда в течение длительного периода доминируют общие симптомы: лихорадка, снижение массы тела, признаки гиповитаминоза, неспецифические лабораторные показатели при отсутствии местных кишечных признаков. Это существенно затрудняет своевременную диагностику, заставляя врача предполагать совершенно иное заболевание. Во всяком случае в круг диагностического поиска при Б К включается большое количество заболеваний, имеющих сходные черты с БК. Прежде всего в круг диагностического поиска включаются злокачественные образования, хронические инфекции, системные заболевания (диффузные заболевания соединительной ткани). Несмотря на совершенство методов исследования, диагноз Б К ставится спустя 1 — 2 года после появления первых симптомов. Если доминируют «кишечные» симптомы, то диагноз можно поставить значительно раньше. При наличии «кишечных» симптомов дифференциальная диагностика проводится с кишечными инфекциями (дизентерия, сальмонеллез), неспецифическим язвенным колитом (НЯК), хроническим неязвенным колитом, хроническим энтеритом, раком толстой кишки. Бактериологическое и эндоскопическое исследование (в сочетании с клиническими признаками) позволяет поставить точный диагноз. Во всяком случае при наличии «кишечных» симптомов у больного Б К должна включаться в круг диагностического поиска. Формулировка развернутого клинического диагнозастроится по следующей схеме: 1) клиническая форма (с учетом преимущественного поражения тех или иных отделов желудочно-кишечного тракта); 2) степень тяжести поражения кишечника (с учетом данных эндоскопии); 3) фаза заболевания (ремиссия — обострение); 4) внекишечные поражения; 5) осложнения. Лечение.При лечении БК следует учитывать локализацию процесса, активность и продолжительность заболевания, возраст и общее состояние больного. Диета, приближаясь к нормальной, не должна содержать плохо переносимые продукты. При поражении тонкой кишки с наличием стеатореи и непереносимости жиров рекомендуется диета с высоким содержанием белка и ограничением жира, лактулезы и грубоволокнистых продуктов. Этиологическая терапия Б К невозможна, так как этиология и патогенез болезни неизвестны. Тем не менее к препаратам первого ряда относятся сульфасалазин, глюкокортикоиды и метронидазол. Сульфасалазин назначают при умеренной активности процесса по 0,5—1 г/сут, а затем по 2 — 4 г/сут в течение 6 — 8 нед с постепенным переходом на поддерживающую дозу (половина лечебной), которая сохраняется не менее 1 года. Препарат принимают вместе с пищей, что предупреждает раздражение желудка. В тяжелых случаях Б К используют глюкокортикоидные препараты — внутрь преднизолон по 40 — 8- мг/сут на протяжении 4 — 8 нед с последующим снижением дозы (по 5 мг каждую неделю). Поддерживающая доза может составлять 5— 10 мг в течение 6 мес и более. При перианальных поражениях и свищах назначают метронидазол (0,75-2 г/сут). При диарее назначают антидиарейные препараты (имодиум, реасек), ферментные препараты. Гипоальбуминемия корригируется введением плазмы, растворов альбумина и аминокислот, при электролитных нарушениях вводят растворы калия, кальция. По достижении ремиссии лекарственное лечение прекращают. Проводится заместительная терапия, включающая витамины Вп, фолиевую кислоту, микроэлементы. Антидиарейные препараты (имодиум, реасек) назначают при необходимости. Продолжительность ремиссии БК различна, в среднем она составляет 2 года (и не зависит от методов предшествующей терапии). Прогноз.Зависит от распространенности поражения, выраженности синдрома нарушенного всасывания и осложнений. Комплексная терапия может существенно смягчить проявления болезни, однако длительная ремиссия обычно не наступает. Хирургические вмешательства при патологии аноректальной области улучшают состояние больных. Профилактика.Специфических методов профилактики не существует. Профилактика сводится к предупреждению обострений, что достигается упорным лечением. Больных ставят на диспансерный учет, чтобы своевременно выявить начинающееся обострение или осложнение. ХРОНИЧЕСКИЙ ГЕПАТИТ Хронический гепатит — диффузное воспалительно-дистрофическое хроническое поражение печени различной этиологии, характеризующееся (морфологически) дистрофией печеночных клеток, гистиолимфо-плазмоцитарной инфильтрацией и умеренным фиброзом портальных трактов, гиперплазией звездчатых ретикулоэндотелиоцитов при сохранении дольковой структуры печени. Согласно Международной классификации болезней, термин «хронический гепатит» обозначает диффузный воспалительный процесс в печени, продолжающийся более б мес. Хронический гепатит может быть самостоятельным в нозологическом отношении заболеванием, а также быть частью какого-либо другого заболевания, например системной красной волчанки (в этом случае его рассматривают как синдром). Следует разграничить хронический гепатит от неспецифического реактивного гепатита, являющегося синдромом различных патологических процессов, в первую очередь поражений желудочно-кишечного тракта. Течение неспецифического реактивного гепатита зависит от основного заболевания. Хронический гепатит является распространенным заболеванием, им страдают люди обоего пола и самого различного возраста, однако отмечают большую его частоту у лиц пожилого и старческого возраста (это связывают с возрастным ослаблением иммунных реакций, что имеет отношение к механизмам развития патологического процесса в печени). Классификация. Внастоящее время общепринятой классификации хронических гепатитов нет. Предложения Международной группы экспертов, высказанные на Всемирном конгрессе гастроэнтерологов в Лос-Анджелесе (1994), не являются общепринятыми, а некоторые их положения в настоящее время невозможно использовать в практической деятельности врача. Классификация хронических гепатитов, предложенная в 1993 г. С. Д. Подымовой, представлена в несколько сокращенном и упрощенном виде. Этиологическая: 1. Вирусный. 2. Лекарственный. 3. Токсический. 4. Алкогольный. 5. Генетически детерминированный. Морфологическая: 1. Агрессивный. 2. Персистирующий. 3. Лобулярный. 4. Холестатический. Клиническая: 1. Хронический активный вирусный гепатит. 2. Аутоиммунный. 3. Персистирующий. 4. Лобулярный. /7о активности процесса: 1. Активный (степень активности незначительная, умеренная, выра 2. Неактивный. Ло функциональному состоянию печени: 1. Компенсированный. 2. Декомпенсированный. Этиология. Из классификации вытекает чрезвычайное разнообразие этиологических факторов, приводящих к развитию болезни. Основную массу хронических гепатитов составляют заболевания вирусной этиологии. Наиболее частой причиной их развития считается пер-систенция вируса В (HBV) самостоятельно или в сочетании с вирусом гепатита дельта (HDV), а также вируса гепатита С (HCV). Для этих вирусов характерны одинаковые пути распространения (главным образом парентеральный) и длительная персистенция в организме. Вирусы гепатита A (HAV) и Е (HEV) имеют орально-фекальный механизм передачи, не могут длительно персистировать в организме и поэтому практически не являются причиной хронических гепатитов (после перенесенного вирусного гепатита А хронический гепатит формируется в 1-2 % случаев). В рамках инфицирования HBV возможно развитие всех видов хронического гепатита — хронического персистирующего гепатита (ХПГ), хронического лобулярного гепатита (ХЛГ), хронического активного гепатита (ХАГ). У 40-50 % больных ХПГ, у 70-80 % больных ХЛГ и у 35 % больных ХАГ заболевание начинается с типичной картины острого вирусного гепатита. Не исключается роль вирусов и в развитии хронического аутоиммунного гепатита (HBV, HCV, HDV, вируса Эпштейна — Барр и вируса простого герпеса). Несмотря на то что этиология хронического аутоиммунного гепатита (ХАИГ) до сих пор не является точно установленной, в его развитии су- щественная роль принадлежит генетической предрасположенности к нарушениям функционирования иммунной системы. Возможны следующие исходы взаимодействия вируса и иммунной системы: а) отсутствие иммунной реакции на возбудитель и хроническое бес б) острый некроз гепатоцитов; в) полная элиминация вируса и выздоровление; г) недостаточная иммунная реакция (неполная элиминация вируса) и Среди других причин выделяют: 1. Хронические производственные интоксикации: а) хлорированными углеводородами (широко применяются в ма- б) хлорированными нафталинами и дифенилами (применяются для в) бензолом, его гомологами и производными (применяются для г) металлами и металлоидами (свинец, ртуть, золото, марганец, 2. Лекарственные поражения печени: а) прямого гепатотоксического действия (антибиотики, антиметабо б) токсико-аллергического действия (психотропные средства, про Чаще всего поражения печени развиваются на фоне лечения несколькими препаратами или при повторном курсе и не всегда зависят от длительности приема лекарственных средств. 3. Алкоголь (помимо жировой дистрофии печени, вызывает алкоголь Патогенез.Хроническое течение и прогрессирование патологического процесса в печени в настоящее время объясняют: 1) длительным сохранением вируса в организме больного; 2) развитием аутоиммунных процессов. Возбудитель хронического гепатита HBV — крупный ДНК-содержа-щий вирус. На наружной его поверхности находится поверхностный антиген — HBsAg; ядерными антигенами являются HBcAg и HBeAg. Ядро вируса содержит ДНК HBV (HBV-DNA) и ДНК-полимеразу (DNA-P). Все эти вирусные компоненты и антитела к его антигенам являются специфическими маркерами данной инфекции. В своем развитии HBV проходит две фазы: фазу репликации и фазу интеграции. В фазу репликации геномы вируса и клетки автономны (в эту фазу возможна полная элиминация вируса из организма). Повреждение гепатоцитов обусловлено не самим вирусом, а иммунекомпетентными клетками, распознающими его антигены. HBcAg и HBeAg обладают сильными иммуногенными свойствами, a HBsAg — слабыми иммуногенными свойствами. В фазу репликации HBV, когда синтезируются HBcAg и HBeAg, сила иммунных реакций достаточно высока, в результате чего не-кротизируются гепатоциты. В фазу интеграции HBV происходит встраивание генома вируса в область клеточного генома (элиминация вируса в эту фазу невозможна). В большинстве случаев формируется состояние иммунологической толерантности к HBsAg, что приводит к купированию активности процесса (в ряде случаев может происходить регресс хронического гепатита вплоть до формирования «здорового» носительства HBsAg). При инфицировании HBV характер поражения печени и хронизация процесса зависят от иммунного ответа, который во многом генетически детерминирован. Длительное сохранение (персистирование) вируса в организме больного объясняется недостаточной силой иммунной реакции в ответ на появление антигенов вируса в организме. Вероятно, имеется недостаточная продукция противовирусных антител. Даже отсутствие антител к HCV в ряде случаев не исключает диагноз хронического гепатита, вызванного вирусом С. В целом антитела к HCV образуются медленно, что занимает в среднем 20 нед от момента инфицирования. У некоторых больных для образования антител требуется около года. Кроме того, вирус, повреждая мембрану гепатоцита, высвобождает мембранный липопротеид, входящий в структуру специфического печеночного антигена. Этот антиген, воздействуя на Т-лимфоциты, приводит к образованию «агрессивных» форм этих клеток. Однако эти клетки функционально неполноценны, и «атака» ими гепатоцитов, ставших для организма чужеродными (вследствие воздействия на них вируса), хотя и приводит к гибели последних, но не обеспечивает полной элиминации вируса из организма. Аутоиммунные реакции развиваются вследствие того, что под воздействием самых различных патогенных факторов гепатоцит приобретает новые антигенные детерминанты (становится «аутоантигенным»), что обусловливает ответную реакцию иммунной системы в виде продукции ауто-антител. Имеющийся генетический дефект иммунной системы («слабость» Т-супрессоров) обусловливает неконтролируемую продукцию аутоанти-тел, реакция «антиген — антитело» на поверхности гепатоцитов вызывает их гибель; формирующиеся иммунные комплексы (вначале циркулирующие, а затем фиксированные в микроциркуляторном русле) обусловливают наряду с поражением гепатоцитов вовлечение в патологический процесс других органов и систем. Гуморальные и клеточные иммунные реакции и поражение гепатоцитов обусловливают морфологические признаки хронического гепатита — гистио-лимфоцитарную инфильтрацию портальных трактов, дистрофические и некротические изменения гепатоцитов и эпителия желчных ходов (схема 19). Нарушаются основные функции печени во всех видах обмена веществ, изменяется ее внешнесекреторная и дезинтоксикационная способ-
ность, формируются основные клинические печеночные синдромы, лежащие в основе проявления болезни. В зависимости от выраженности тех или иных морфологических проявлений (дистрофия и некроз гепатоцитов, или гистиолимфоцитарная инфильтрация портальных и перипорталь-ных трактов, или инфильтрация стенок желчных ходов с развитием некроза эпителия желчных ходов) формируется тот или иной (активный, персистирующий или холестатический) гепатит. При слабой реакции иммуноцитов на антигены гепатоцитов развивается персистирующий гепатит (ХПГ), а при сильном типе реакции — активный гепатит (ХАГ). В ряде случаев иммунный процесс приводит к повреждению эндоплаз-матического ретикулума гепатоцита, что проявляется нарушением образования желчных кислот из холестерина. Иммунные реакции могут нарушать проницаемость желчных капилляров и повышать вязкость желчи. Эти и другие факторы способствуют развитию внутрипеченочного холестаза. Развитие аутоиммунного процесса при антигенположительном гепатите связано с персистирующей реактивацией Т-лимфоцитов-хелперов вследствие неадекватной элиминации вируса гепатита из организма (в результате недостаточного синтеза антител к HBsAg). При всех вирусах гепатита (HBV, НВС и HBD) определяются аутоантитела. Кроме того, ус- тановлен факт репликации HBV и НВС вне гепатоцитов и вне ткани печени. Это может быть одним из объяснений многосистемности поражения при ХАГ и ХАИГ. При антигенотрицательном гепатите патологический процесс развивается на фоне нормального синтеза антител к поверхностному антигену, что приводит к адекватной элиминации вируса гепатита из организма, а заболевание все-таки прогрессирует. Более вероятно это объяснить генетически детерминированным дефектом супрессивной функции Т-лимфоцитов. Клиническая картина.Проявления болезни чрезвычайно разнообразны. Клиническая картина зависит от формы хронического гепатита (активный, аутоиммунный, персистирующий, лобулярный или холестатичес-кий), активности процесса, функционального состояния печени и определяется выраженностью основных клинических синдромов: 1) цитолити-ческого; 2) мезенхимально-воспалительного (иммуновоспалительного); 3) холестатического; 4) астеновегетативного; 5) диспепсического; 6) геморрагического; 7) синдрома гиперспленизма. • Цитолитический синдром (с признаками печеночно-клеточной не Клинические признаки — снижение массы тела; лихорадка; желтуха; геморрагический диатез; печеночный запах; внепеченочные знаки («печеночный» язык, «печеночные ладони», или пальмарная эритема, сосудистые звездочки, изменение ногтей, оволосения, гинекомастия и пр.). Лабораторные признаки: а) снижение в сыворотке крови уровня альбуминов, протромбина, холестерина, холинэстеразы, V, VII факторов свертывания крови; б) повышение в сыворотке крови содержания билирубина (связанного); в) изменения ферментных показателей сыворотки крови (повышение уровня ACT, АЛТ, ЛДГ, альдолазы, митохондриаль-ных — глутаматдегидрогеназы, сорбитдегидрогеназы — и лизосомальных ферментов — кислой фосфатазы, (3-глюкуронидазы); г) снижение захвата бромсульфалеина и бенгальского розового 1311 — результат уменьшения функциональной способности печени; д) снижение превращения токсичных продуктов обмена в нетоксичные — нарушение дезинтоксикационной функции печени. • Мезенхималъно-воспалительный синдром. Клинические признаки: Лабораторные признаки: а) повышение уровня у-глобулинов, часто с гиперпротеинемией, изменение осадочных проб, уровня иммуноглобулинов классов G, М, А; б) появление LE-клеток, неспецифических антител к ДНК, гладкомышечным волокнам, митохондриям; в) снижение титра комплемента, теста бласттрансформации лимфоцитов (БТЛ) и реакции торможения миграции лейкоцитов (ТМЛ); появление антител к тканевым и клеточным антигенам (гладкомышечным, митохондриальным, нуклеар-ным и др.). • Холестатический синдром. Клинические признаки: а) упорный д) лихорадка (при наличии воспаления); е) потемнение мочи, по-светление кала (нехарактерный симптом). Лабораторные признаки — повышение уровня билирубина (связанного); холестерина, р-липопротеидов, щелочной фосфатазы, у-глутамат-транспептидазы. • Астеновегетативный синдром. Клинические признаки: а) сла • Диспепсический синдром. Клинические проявления: а) тошнота, • Геморрагический синдром. Клинические проявления: а) кровоточи Лабораторные признаки: а) уменьшение количества и изменение функциональных свойств тромбоцитов; б) уменьшение синтеза факторов свертывания крови (II, V, VII). • Синдром гиперспленизма. Лабораторные признаки: а) анемия; Хронический активный гепатит (ХАГ)характеризуется ярко выраженной клинической симптоматикой, которая может быть объединена в три основных синдрома: 1) астеновегетативный; б) диспепсический; в) цитолитический («малой печеночной недостаточности»). С разной степенью выраженности встречаются мезенхимально-воспали-тельный синдром и синдром холестаза. На I этапе диагностического поиска можно выявить связь заболевания с перенесенным ранее вирусным гепатитом (ХАГ может формироваться непосредственно после перенесенного острого вирусного гепатита или же спустя несколько лет); если в анамнезе не удается выявить перенесенный вирусный гепатит, то в таком случае можно предположить, что больной перенес безжелтушную форму болезни. У части больных возможным доказательством перенесенного ранее вирусного гепатита можно считать гемотрансфузии, переливания компонентов крови, частые инъекции, прививки, контакт с больными, страдавшими острыми и хроническими гепатитами. Больных ХАГ часто беспокоит общая слабость, быстрая утомляемость, рассеянность, нередко — подавленное настроение. Диспепсические расстройства (тошнота, понижение аппетита, непереносимость жирной пищи и алкоголя, расстройства стула и пр.) редко достигают значительной выраженности. Преходящая желтуха, кровоточивость и другие жалобы, связанные с проявлением цитолитического синдрома, отчетливо выражены в период обострения заболевания. Желтуха, особенно в сочетании с кожным зудом, может быть результатом и холестаза, также наблюдающегося при этой форме гепатита. В период обострения наблюдаются повышение температуры тела (часто до субфебрильной), боли в суставах, мышцах (нерезко выраженные), проявления мезенхимально-воспалительного синдрома. Указание на проводимое ранее лечение глюкокортикоидами, иммуно-депрессантами служит доводом в пользу ХАГ. На II этапе диагностического поиска выявляют: а) клинические признаки цитолитического синдрома; б) проявления других синдромов: холестаза, геморрагического и пр.; в) увеличение печени. Похудание, изменение оволосения и ногтей, гинекомастия у мужчин, пальмарная эритема, сосудистые звездочки — проявления цитолитического синдрома с признаками печеночно-клеточной недостаточности. Желтушность кожи и слизистых оболочек свидетельствует о поражении печеночных клеток, а также о холестазе. Кожные кровоизлияния являются признаками геморрагического синдрома. Эти симптомы отмечаются непостоянно (примерно у половины больных) и преимущественно в период обострения болезни. Наиболее часто обнаруживают увеличение печени. Печень умеренно плотная, край заострен, пальпация болезненна. Иногда увеличена селезенка. У части больных в период обострения болезни отмечается преходящий асцит (выраженный нерезко). III этап диагностического поиска имеет решающее значение для постановки диагноза ХАГ. Полученные на этом этапе данные позволяют: а) уточнить этиологию (при обнаружении в крови HBsAg); б) определить степень активности процесса; в) определить степень вовлечения в патологический процесс других органов и систем; г) уточнить характер морфологических изменений печени (позволяющий также решить вопрос о возможности трансформации гепатита в цирроз). Клинический анализ крови помогает обнаружить гематологические изменения, характерные для ХАГ: увеличение СОЭ (проявление диспро-теинемии), сочетание анемии, лейкопении и тромбоцитопении — выражение синдрома гиперспленизма. При биохимическом исследовании крови в период обострения ХАГ выявляется значительное нарушение белкового обмена: гипоальбуминемия и гипергаммаглобулинемия, нередко сочетающаяся с гиперпротеинемией; повышение осадочных проб (особенно тимоловой). Нарушения пигментного обмена менее выражены и проявляются умеренным повышением содержания связанного билирубина в крови и уробилина в моче. Как правило, значительно нарушен клиренс бромсульфалеи-на (страдает выделительная функция печени). Задержка бромсульфалеи-на в плазме соответствует тяжести поражения печени. Показателем повреждения клеток печени является изменение активности аминотрансфераз. При ХАГ активность аминотрансфераз (аспартат-и аланинаминотрансферазы) повышается значительно: наблюдается 4 — 8-кратное увеличение их содержания. Значительно повышается уровень лактатдегидрогеназы (ЛДГ) и ее изоферментов ЛДГ-4 и ЛДГ-5. Помимо увеличения содержания аминотрансфераз и ЛДГ (так назы Выраженный синдром цитолиза отражает значительную степень нарушения целостности гепатоцитов и тяжесть течения ХАГ. Снижение уровня холинэстеразы — свидетельство печеночно-клеточной недостаточности. Синдром холестаза, помимо гипербилирубинемии, подтверждается гиперхолестеринемией (при поражении гепатоцитов, свойственном ХАГ, при отсутствии холестаза бывает гипохолестеринемия) и повышением содержания щелочной фосфатазы. На фоне проводимой терапии в случае успеха и достижения ремиссии у большинства больных биохимические показатели частично нормализуются, но иногда не достигают нормальных величин. В особенности это касается сывороточных ферментов (ACT, АЛТ, ЛДГ и др.), содержание в крови которых практически никогда не нормализуется. Иммунологические исследования у 90 % больных выявляют сдвиги, которые выражаются в увеличении содержания IgG, реже — IgM, появлении антител к гладкой мускулатуре и ядерной субстанции. Нарушение иммунологического гомеостаза проявляется также в уменьшении реакции БТЛ (бласттрансформации лимфоцитов) и ТМЛ (торможение миграции лейкоцитов). Для определения маркеров вирусных гепатитов применяют радиоиммунологический или иммуноферментный метод. Маркером вируса гепатита В, определяемым серологическим методом в сыворотке крови, является HBsAg, который выявляется почти во всех случаях ХАГ. При ХАГ в фазе репликации (размножения) серологическими маркерами являются HBeAg, анти-НВс класса IgM, HBV-DNA и DNA-P. Наиболее чувствительными показателями репликации и контагиозности являются DNA вируса (HBD-DNA) и антитела к дельта-вирусу (HDVAg) класса IgM. При одновременном инфицировании HBV и HDV эти антитела сочетаются с анти-HBs и анти-НВс класса IgM. Выявление анти-НВе может указывать на благоприятный прогноз заболевания. Родионуклидное исследование проводится для определения поглотительно-выделительной функции печени. Чаще всего используют два гепа-тотропных красителя — бенгальский розовый и бромсульфалеин, меченные 1311. У больных ХАГ отмечаются снижение поглотительной функции печени и замедление очищения крови от радиоиндикатора. Исследование распределения меченых соединений (чаще всего 198Аи) в печени (сцин-тиграфия) выявляет при ХАГ снижение накопления радиоиндикатора, что свидетельствует об уменьшении функционирующей паренхимы печени. Пункционная биопсия печени — основной метод, позволяющий поставить окончательный клинико-морфологический диагноз и получить представление об активности патологического процесса. Для ХАГ характерны следующие морфологические признаки: а) лимфогистиоцитарная инфильтрация со значительным количест б) некрозы и дистрофические изменения гепатоцитов; наличие пери в) фиброзные изменения портальных трактов, проникающие в дольку. Течение ХАГ может быть непрерывно рецидивирующим или с чередованием обострений и отчетливых клинических, а иногда и биохимических ремиссий. Редко встречается так называемый бессимптомный вирусный ХАГ. У таких больных при обследовании выявляют гепатомегалию, нормальный или нерезко повышенный уровень билирубина, повышение активности аминотрансфераз в 3 — 5 раз. При гистологическом исследовании биоптата печени обнаруживают картину ХАГ с умеренной или незначительной степенью активности. По выраженности клинических проявлений заболевания и нарушения функциональных проб печени выделяют ХАГ с умеренной и высокой активностью воспаления. При умеренной активности в клинической картине доминируют ас-теновегетативный и диспепсический синдромы, а также боли в правом подреберье, обусловленные растяжением печеночной капсулы в связи с гепатомегалией, перигепатитом, поражением внутрипеченочных желчных ходов. При биохимическом исследовании определяют умеренную ги-пергаммаглобулинемию, гипоальбуминемию, гипохолестеринемию, небольшое повышение в сыворотке крови ACT и АЛТ (не более чем в 4 — 5 раз). При высокой активности ХАГ отмечается тяжелое, быстро прогрессирующее течение болезни, сопровождающееся рецидивирующей желтухой, геморрагиями и другими симптомами печеночно-клеточной недостаточности, нередко присоединяются системные проявления (лихорадка, кожные высыпания, артралгии). Значительно нарушаются
Поиск по сайту: |