|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
МЕТОДИ ВИВЧЕННЯ БІЛОК-БІЛКОВИХ ВЗАЄМОДІЙСтр 1 из 4Следующая ⇒
ДОПОВІДЬ НА ТЕМУ: “Білок-білкові взаємодії у регуляції метаболізму прокаріотичних та еукаріотичних організмів”
Виконала Студентка групи БЛБ-52м Лагно О. В.
Перевірила: Доцент Яворська Г. В.
Львів 2010 ЗМІСТ ВСТУП……………………………………………………………………………………………3 1. Структурно-функціональні модулі білок-білкових взаємодій……………………………..3 2. Білкові комплекси……………………………………………………………………………..6 3. Інтерактоми……………………………………………………………………………………6 4. Методи дослідження білок-білкових взаємодій…………………………………………….9 4.1.Дріжджовий двогібридний аналіз…………………………………………………..9 4.2. Методи, засновані на принципах методу подвійного гібриду………………….10 4.3. Бактерійна система подвійних гібридів…………………………………………..15 4.4. Метод фагового дисплею………………………………………………………….15 4.5. Методи мікроскопії………………………………………………………………...16 5. Медико-біологічне значення аналізу білкових взаємодій………………………………...17 ВИСНОВКИ…………………………………………………………………………………….20 ВИКОРИСТАНА ЛІТЕРАТУРА………………………………………………………………21
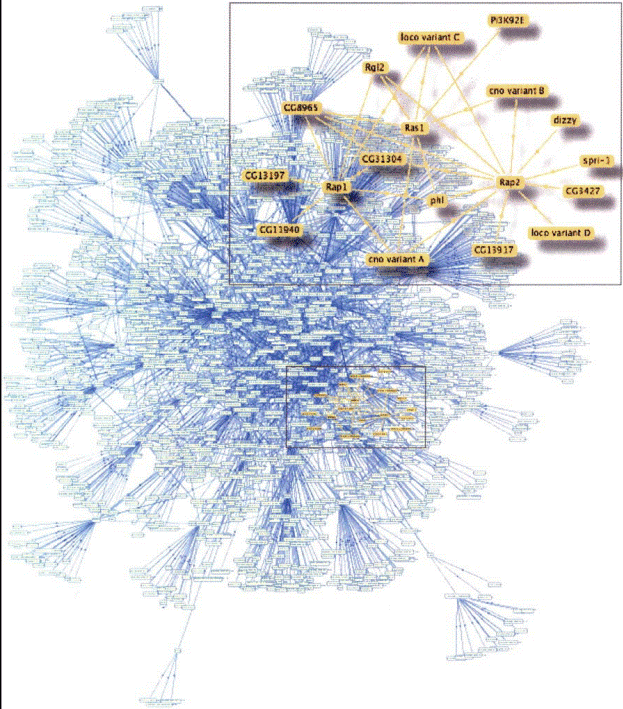
ВСТУП Білок-білкова взаємодія — це зв'язування (зазвичай оборотне) білків, їх вплив один на одного [1]. Білок-білкова взаємодія важлива для багатьох біологічних процесів. Наприклад, сигнали від зовнішньої поверхні клітини передаються до її внутрішніх частин за допомогою білок-білкової взаємодії та взаємодії білків з сигнальними молекулами. Цей процес, що називається передачаю сигналів, відіграє фундаментальну роль в багатьох біологічних процесах і в багатьох хворобах (наприклад, таких як рак). Білки можуть взаємодіяти і протягом довгого часу, формуючі білкові комплекси та допомогаючи транспорту інших білків (наприклад при ядерному транспорті через ядерні пори від цитоплазма клітини до її ядра або навпаки), або можуть взаємодіяти протягом короткого часу, наприклад, змінюючи інші білки в результаті ферментативної реакції (наприклад, білкові кінази фосфорилюють певні інші білки). Ці модифікації білків можуть змінювати взаємодію з іншими білками. Наприклад, деякі білки з SH2-областями зв'язуються з іншими виключно у фосфорильованому стані [6] 1. СТРУКТУРНО-ФУНКЦІОНАЛЬНІ МОДУЛІ БІЛОК-БІЛКОВИХ ВЗАЄМОДІЙ Виявлення одних і тих же білків у складі різних білкових комплексів пояснюється наявністю в їх складі декількох функціонально важливих ділянок, включаючи ті, які відповідальні за білок – білкові взаємодії. Це говорить про мультимодульність будови білків. Дослідження останніх років показують, що модульність є універсальною властивістю живого і виявляється на всіх рівнях його організації, від молекулярного до організменного. Модульність характерна, як вже було згадано, також і для білкових сіток, що обумовлює складний, ієрархічний характер їх організації [1]. У свою чергу, модульна організації може бути властива і окремим білкам, це означає, що білкова молекула може складатися з декількох структурно і функціонально незалежних елементів (доменів). При цьому кожний з модулів відповідальний за ту чи іншу функцію білка і може функціонувати незалежно від інших. В результаті цього білкова молекула набуває здатності виконувати цілий комплекс різних функцій; такі білки називаються мультимодульними і поліфункціональними. Ймовірно, ці функції взаємозв'язані тобто набір функціональних модулів того або іншого конкретного білка, мабуть, утворений не випадковим чином. Який з модулів білка може бути задіяний, залежить від типу клітини, її мікрооточення, фізіологічного і патофізіологічного стану клітини, а також мікрооточення самої білкової молекули. Мозаїчність будови, мультимодульность і поліфункціональність характерні для більшості білків еукаріот. Структурно подібні модулі можуть зустрічатися у складі різних білків, обумовлюючи подібність деяких їх функцій. Можливо, що молекули різних білків побудовані шляхом різної комбінації обмеженого набору структурно і функціонально незалежних модулів, що, у свою чергу детерміновано фізіологічною (біологічною) роллю того або іншого білка. Дане припущення підтверджується експериментами по створенню штучних поліфункціональних білків, утворених різним поєднанням пептидів з вже відомою функцією. Ці експерименти показали що: 1) компактна упаковка білкової молекули не є необхідною умовою для реалізації її функцій; 2) функції того або іншого пептиду залежать від їх набору і взаємного розташування. Більш того, виявилось, що шляхом перегруповувань різних послідовностей можна отримати білки з абсолютно різними функціями. Мультимодульність білків може привести до значного ускладнення білкових комплексів. У випадку, якщо у вузлах білкових сіток розташовуються мультимодульні, поліфункціональні білки, то кожен вузол може бути представлений не окремим білком а його функціональним модулем, і зв'язки між вузлами стають взаємопереплетиними. У зв'язку з цим важливим є складання структурно-функціональних карт для мультимодульних і поліфункціональних білків з метою виявлення ділянок, відповідальних за ту або іншу функцію, зокрема за білок-білкові взаємодії. Експериментально показано, що білок-білкові взаємодії утворюються за допомогою доменів одних білків і відповідних їм коротких лінійних пептидних послідовностей інших білків. Якщо білок містить декілька доменів для взаємодії або декілька зв'язуючих послідовностей, то він може одночасно взаємодіяти з декількома білками, що призводить до утворення білкових комплексів. Прикладами доменів, що беруть участь у білок-білкових взаємодіях є SH2 і PTB домени, що зв'язуються з фосфорильованими залишками тирозину в складі рецепторів або з SH3 і WW доменами, що взаємодіють з пролин-багатими послідовностями білків [7]. Однією з модельних систем для вивчення білок-білкових взаємодій є взаємодія SH3-доменів з білками, що містять багаті проліном домени. Білкові сітки утворені в результаті взаємодії різних білків з SH3 доменами були виявлені у S. cerevisia, у якої визначено 28 білків, що містять такі домени. З використанням Y2H методу було виявлено 233 взаємодії за участю 145 білків, метод фагового дисплею виявив 394 взаємодії між 206 білками [9]. Вивчення будови SH3-доменов показало, що їх поліпептидний ланцюг містить близько 50–70 амінокислотних залишків і організований в п'ять В-складчастих структур. В даний час відомо більше 1500 різних SH3-доменов, класичною ділянкою прикріплення яких є PXXP послідовність (де Р - пролін, а X – будь-яка амінокислота). SH3-домени містяться у складі таких ферментів, як кіназа, ліпаза або ГТФ-аза. Найбільш вивчені функції SH3 доменов адаптерних білків, таких як c-Src або Grb2, що беруть участь у передачі сигналу всередину клітини, від мембранних рецепторів до їх цитоплазматичних ефекторів. Так, за участю PXXP послідовності, багата проліном тирозинфосфатаза (PEP – proline-enriched tyrosine phosphatase) зв'язується з SH3-доменом цитоплазматичної тирокінази Csk (C-terminal Src kinase). Показано, що в цій взаємодії задіяна ділянка, яка включає A40, T42 і L43 в складі SH3-домена, утворюючи гідрофобні зв'язки з PEP. Іншим прикладом є взаємодія PXXP послідовності білків з очищеними SH3-доменами таких білків, як с-Src, Grb2 і інтерсектином. Дослідження кінетики подібних взаємодій показало, що різні SH3-домени можуть зв'язуватися з одним і тим же пролин-багатим доменом. Мабуть, в умовах in vivo декілька SH3-доменов можуть конкурувати за зв’язування з PXX послідовностями. Короткі лінійні послідовності або сегменти білків, що складаються в основному з 3–10 амінокислотних залишків послідовності відповідальні за ту або іншу функцію білка. Вони беруть участь в білок-білкових взаємодіях за типом білок-ліганд, білок-нуклеїнова кислота і є ділянками посттрансляційних модифікацій білків таких як фосфорилювання, глікозилювання і ін. Першими лінійними послідовностями, виявленими у складі білків, були послідовності KDEL і НDEL, що є ділянками білків ендоплазматичного ретикулюму і відповідальні за регуляцію секреції цих білків. Було також показано що послідовність KKXX, виявлена в цитоплазматичному u1076 домені трансмембранних білків виконує функцію сигнальної ділянки відповідальної за повернення білків з апарату Гольджі в цистерни ендоплазматичного ретикулюму [2, 7]. Короткі лінійні послідовності, що складаються з невеликої кількості амінокислотних залишків, важко виявити шляхом порівняння первинних послідовностей білків. І тому для їх виявлення часто використовуються досить трудомісткі і багатоетапні експериментальні методи. Для виявлення коротких лінійних послідовностей і ролі тих або інших амінокислотних залишків в їх функціонуванні зазвичай використовуються такі експериментальні методи, як точковий мутагенез або фаговий дисплей. В даний час з'являються нові біоінформаційні ресурси для виявлення коротких лінійних послідовностей у складі білків. Комп'ютерні методи для виявлення зв'язуючих послідовностей засновані на використанні баз даних по білок-білкових взаємодіях і визначенні послідовностей, загальних для групи взаємодіючих один з одним білків. Для цього можуть бути використані спеціальні алгоритми такі, як D-MOTIF, D-STAR, MEME, Gibbs Sampler, PRATT і TEIRESIA. Даний підхід заснований на припущенні, що білки, які мають загальних взаємодіючих партнерів, повинні характеризуватися подібними послідовностями. Нові бази даних містять інформацію про всі відомі функціонально важливі ділянки білків. Так, наприклад база даних SCOWLP містить інформацію про більш ніж 9 тисячах білок-зв’язуючих ділянок, які належать більш ніж до 2,5 тисяч родин. При цьому, виявилось, що представники 65% родин містять більше ніж одну зв'язуючу ділянку, а 22% ділянок задіяні у формуванні комплексів з декількома білками, що належать різним родинам. Методи порівняльної геноміки і кластеризації генів були використані для виявлення функціонально важливих олігопептидів у білках семи біологічних видів. Даний підхід дозволив виявити три- і тетрапептиди з вже відомою функцією, такі як сигнальні послідовності SKL, KDEL/НDEL і KKXX, а також передбачити нові послідовності, які можливо, мають функціональне значення. Спеціальні пристрої дають можливість визначати потенційні контакти між амінокислотними залишками відразу декількох поліпептидних ланцюгів. Так, алгоритм Con-Struct Map дозволяє вивчати зміни, що відбуваються в просторовій структурі білків в результаті замін амінокислотних залишків, або, навпаки визначати консервативні залишки, важливі для взаємодії та досліджувати структурно-функціональні взаємовідносини з неспорідненими, не гомологічними білками [1]. БІЛКОВІ КОМПЛЕКСИ Білок-білкові взаємодії обумовлюють утворення стабільних білкових комплексів, що мають важливе функціональне значення. Методами мікроскопії було виявлено, що в цитоплазмі живих клітин білкові молекули розподілені не рівномірно, а існують у вигляді окремих скупчень. У таких скупченнях, де вміст макромолекул може коливатися від 50 до 400 г/л, полегшуються білок-лігандні і білок-білкові взаємодії, конформаційні переходи макромолекул і утворення самоорганізованих надмолекулярних структур [1]. Методи сучасної протеоміки дозволяють достатньо детально охарактеризувати вміст і способи організації цих внутрішньоклітинних структур. Білкові комплекси є ключовими надмолекулярними структурами, в яких інтегровані продукти декількох генів і які, в основному, призначені для виконання яких-небудь взаємозв'язаних функцій. Це може бути мультиферментний комплекс, призначений для каталізу послідовності біохімічних реакцій, або комплекс білків – учасників шляхів передачі сигналу. Білкові комплекси утворюються завдяки тому, що кожна білкова молекула може володіти відразу декількома білок-звязуючими ділянками. Так, наприклад, вивчення лінкерного білка для активації Т-лімфоцитів, LAT (linker for activation of T cells) показало, що в його взаємодії з SH2-доменами адаптерних білків сигнальних шляхів беруть участь чотири ділянки, що містять фосфорильовані залишки тирозину. Це сприяє утворенню білкових комплексів, які полегшують передачу сигналу з мембрани всередину клітин, що лежить в основі нормального дозрівання і диференціювання імунокомпетентних клітин. Мутації що приводять до заміни залишків тирозину, приводять до порушень диференціювання Т-лімфоцитів і дозрівання В-лімфоцитов [7]. У білкових комплексах можна виділити ядро, яке утворене постійним набором білків, і периферійну частину, склад якої може змінюватися. Показано, що існує u1082 кооперативність взаємодії між різними білками у складі такого комплексу, що визначається різною аффінністю і специфічністю їх зв'язуватися один з одним. Характер і механізм асоціації і дисоціації білкових комплексів, в основному, залежить від їх розмірів. Дослідження з S. cerevisiae показали експоненціальне падіння розподілу розмірів білкових комплексів. Проте вивчення динаміки білкових комплексів виявило, що їх асоціація може відбуватися незалежно від розміру комплексу. Частина білків може брати участь в утворенні відразу декількох комплексів, що може пояснюватися полі функціональністю і мультимодульністю цих білків. Оскільки білкові комплекси призначені в основному, для виконання будь-якої визначеної функції, поліфункціональні білки можуть реалізовувати свої можливості у складі різних комплексів за участю різних функціональних модулів [1, 7]. ІНТЕРАКТОМИ Безліч білків в клітині знаходиться в динамічній взаємодії один з одним, і ці взаємодії обумовлюють функціонування і поведінку живої клітини. Оборотні білок-білкові взаємодії є одним з видів динамічних процесів, що відбуваються в клітині і дозволяють говорити про її функціонуванні. Інтенсивні дослідження, здійснювані в області протягом останніх років, сприяли поступовому нагромадженю даних про взаємодіючі пари білків і про утворенні ними білкові комплекси. Протягом останніх двох десятиліть був розроблений ряд високоефективних і високопродуктивних експериментальних методів для вивчення білкових взаємодій, які, проте, не позбавлені недоліків. Тому експериментальні методи доповнюються різними теоретичними підходами, включаючи математичні комп'ютерні методи досліджень. При цьому білок-білкові взаємодії вивчаються окремо для різних біологічних видів. Окремо для вищих еукаріотичних організмів – також окремо для різних тканин і типів клітин. Вся сукупність білок-білкових взаємодій, характерна для даного організму, отримала назву інтерактома. Структурна організація інтерактомів і загальна кількість взаємодій в них є одними з важливих чинників, що визначають складність біологічних систем. Кількість копій тих або інших білків в одній клітині, може коливатися від декількох десятків до мільйонів. Тому інтерактоми навіть простих організмів можуть бути утворені досить великою кількістю взаємодій. Так, наприклад, розмір інтерактоми у дріжджів S. сerevisia може складати, за одними даними, до 10–17 тисяч, взаємодій, а за іншими – до 25–35 тисяч взаємодій. Статистична оцінка можливого розміру інтерактоми людини показала, що вона може утворюватися приблизно 650 тисячами взаємодій [4]. При цьому розмір інтерактоми людини опинився приблизно в 10 разів більшим, ніж у D. melanogaster, і може в 3 рази перевищувати розмір інрерактоми C. elegans. Ці дані дозволили зробити припущення про те, що розмір інтерактома корелює з рівнем організації того чи іншого біологічного виду. Визначення фізично взаємодіючих пар білків дозволяє складати інтерактомні карти, в яких є певні графи, що складаються з вузлів, де розташований той або інший білок, і зв'язків між ними, що показують парні взаємодії (мал. 1). Інтерактомні карти розглядаються як ключі для отримання знань про функціонування білків в клітинах [1, 3].
Мал. 1. Карта білок-білкових взаємодій у Drosophila melanogaster. У окремому вікні в збільшеному вигляді показана схема, яка включає Ras і ГТФ-ази. На підставі даних, отриманих методами in vitro, складаються статичні інтерактомні карти, аналіз яких, як буде показано далі, дозволяє описувати динамічні білок-білкові взаємодії, що існують в умовах in vivo. Складання інтерактомних карт є досить важливим для фундаментальної медицини а саме для визначення ролі окремих білків і їх взаємодій у виникненні і розвитку захворювань, їх діагности а також можливих мішеней для дії різних ліків і контролю ефективності лікування [4]. Відомі в даний час інтерактомні карти досить неповні навіть для простих організмів. Крім того, дані отримані різними групами авторів, часто суперечливі. Експериментальними методами в даний час визначаються взаємодіючі пари білків і білкові комплекси, в основному, у прокаріот або простих еукаріотичних організмів. Для виявлення білок-білкових взаємодій у складніших організмів, таких як ссавці, додатково використовується метод прогнозу їх на підставі гомології з білками, взаємодіючі партнери для яких були виявлені у простіших організмів. Даний підхід заснований на існуванні гомології між спорідненими білками і порівнянні ступеня консервативності первинної і просторової структури одного і того ж білка у різних біологічних видів. Наприклад, якщо експериментально показано, що два будь-які білки у дріжджів взаємодіють один з одним, то передбачається що у людини ці білки також взаємодіють. Дві пари білків у різних організмів, що еволюційно зберегли здатність взаємодіяти один з одним, отримали назву інтерологів. Прогноз взаємодіючих пар білків дає більш менш надійні результати лише за умови високого ступеня подібності їх первинних послідовностей. Крім того як показують дослідження останніх років, дані, отримані за допомогою високоефективних експериментальних методів можуть бути неточними (надійність навіть таких методів, як дріжджовий двогібридний аналіз, не перевищує 50%. Тому час цілий ряд робіт присвячений уточненню і коректуванню вже наявних даних з використанням поєднання різних експериментальних і теоретичних методів для побудови точніших карт фізичної взаємодії білків [1]. МЕТОДИ ВИВЧЕННЯ БІЛОК-БІЛКОВИХ ВЗАЄМОДІЙ
Поиск по сайту: |