|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Классификация коферментовСтр 1 из 4Следующая ⇒
НУКЛЕОТИДЫ.
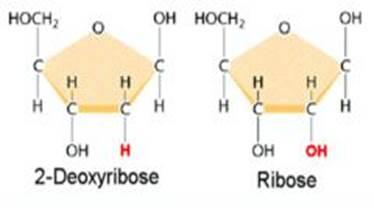
В каждом живом организме присутствуют 2 типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). ДНК и РНК состоят из мономерных единиц - нуклеотидов, поэтому нуклеиновые кислоты называют полинуклеотидами. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. Азотистые основания — это ароматические гетероциклические соединения, производные пиримидина или пурина. Пять соединений этого класса являются основными структурными компонентами нуклеиновых кислот. Пуриновые основания аденин (Ade, но не А) и гуанин (Guа), а также пиримидиновое основание цитозин (Cyt), входят в состав ДНК и РНК. В состав ДНК входит также тимин (Thy), 5-метил-производное урацила. Основание урацил (Ura) входит только в состав РНК. В ДНК высших организмов в небольшом количестве присутствует 5-метилцитозин. Производные азотистых оснований присутствуют в тРНК (см.с. 88) и в других типах РНК. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Положения атомов в ароматическом кольце пронумерованы в соответствии с принятой номенклатурой. Цитозин,тимин и урацил в нуклеиновых кислотах содержится в значительных количествах, а 5-метилцитозин,оротовая кислота и 5-оксиметил цитозин – в ничтожных и далеко не всегда. Поэтому они называются минорными (экзотическими основаниями). Углеводные компоненты: рибоза и дезоксирибоза. Дезоксирибо́за C5H10O4 — углевод, альдопентоза: моносахарид, содержащий пять атомов углерода и альдегидную группу в линейной структуре. Это дезоксисахар — производное рибозы, где гидроксильная группа у второго атома углерода замещена водородом с потерей атома кислорода (дезокси — отсутствие атома кислорода). Химическая формула была открыта в 1929 году Фибусом Ливеном (Phoebus Levene). Рибоза формирует пятичленное кольцо, состоящее из четырёх атомов углерода и атома кислорода. Гидроксильные группы соединены с тремя атомами углерода. Последний атом углерода и гидроксильная группа связаны с одним из атомов углерода, соединённых с кислородом. В дезоксирибозе атом углерода, расположенный дальше всего от атома кислорода, лишён гидроксильной группы. Входит в состав ДНК, вместе с азотистым основанием и остатком фосфорной кислоты образуя мономерную единицу дезоксирибонуклеиновой кислоты — нуклеотид. Особенности рибозы и дезоксирибозы. 1. Рибоза С5H10O5 и дезоксирибоза С5H10O4 – кристаллические вещества сладкого вкуса, растворимые в воде. 2. Состав дезоксирибозы не отвечает формуле Сn(Н2О)m, считавшейся общей формулой всех углеводов. 3. Дезоксирибоза отличается от рибозы отсутствием в молекуле одной гидроксильной группы (оксигруппы), которая заменена атомом водорода. Отсюда и произошло название вещества (дезоксирибоза). Структурные формулы:
СН2-СН-СН-СН-С-Н=О (рибоза). 4. Они точно указывают, при каком именно атоме углерода дезоксирибозы нет гидроксильной группы. 5. Подобно глюкозе молекулы пентоз существуют не только в альдегидной, но и в циклической форме. Замыкание кольца в них можно представить аналогичным образом. Отличие будет лишь в том, что карбонильная группа взаимодействует с гидроксилом не пятого, а четвертого атома углерода, и в результате перегруппировки атомов образуется не шестичленный, а пятичленный цикл. Как и в случае глюкозы, пентозы известны в двух циклических формах в водном растворе они ннаходятся в подвижном равновесии с альдегидной формой. Химические свойства рибозы и дезоксирибозы. 1. При окислении по альдегидной группе они образуют соответствующие кислоты. 2. При восстановлении пентозы превращаются в многоатомные спирты. 3. Рибоза и дезоксирибоза имеют большое биологическое значение. 4. Они входят в состав нуклеиновых кислот, которые осуществляют в клетках организмов синтез белков и передачу наследственных признаков.
Нуклеозиды– это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой. Между аномерным атомом углерода моносахарида и атомом азота в положении 1 пиримидинового цикла или атомом азота в положении 9 пуринового цикла образуется β-N-гликозидная связь.
В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) и дезоксирибонуклеозиды (содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях.
Для обозначения нуклеозидов используются однобуквенные обозначения, входящих в их состав нуклеиновых оснований. К обозначениям дезоксирибонуклеозидов ( за исключением тимидина) добавляется буква ”д”. В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность. Как N-гликозиды, нуклеозиды устойчивы к действию щелочей, но расщепляются под действием кислот с образованием свободного моносахарида и нуклеинового основания. Пуриновые нуклеозиды гидролизуются значительно легче пиримидиновых. Нуклеотиды. Известно, что нуклеотиды называются аденин, гуанин, тимин, цитозин и урацил – азотистые основания, они представлены на рисунке ниже.
В более широком смысле-соед., в к-рых моносахаридный остаток нуклеозида или его неприродного аналога этерифицирован одной или неск. моно- или олигофосфатными группами. В зависимости от природы нуклеозида различают рибо- и дезоксирибонуклеотиды, пиримидиновые и пуриновые нуклеотиды. Обычно используют сокращенные обозначения нуклеотидов. Напр., аденозин-5'-монофосфат, или адениловую к-ту обозначают 5'-АМФ, или AMP; аденозин-5'-дифосфат -АДФ, или ADP; 2'-дезоксицитидин-5'-три-фосфат дЦТФ, или dCTP. Длина эфирной связи Р—О в фосфатной группе нуклеотидов (ок. 0,16 нм) меньше длины обычной простой связи (0,171 нм); т.е. вклад p-связи близок к 35%. Вследствие sр2-гибридиза-ции валентный угол при атоме кислорода в группировке Р—О—R увеличен до 118-120° и вращение вокруг связи С—О более заторможено, чем вокруг связи Р—О. Почти все торсионные углы в молекуле нуклеотидов коррелируют между собой. Обычно нуклеотиды конформационно менее подвижны, чем нуклеозиды, что не исключает наличия неск. конформации в динамич. равновесии, но сказывается на их относит. заселеннести. В особенности это относится к вращению вокруг N-гликозидной связи и связи между атомами С-4'—С-5'. Конформации нуклеотидов (как и нуклеозидов) стабилизируются взаимод. С—Н-атомов основания с 5'-О; в нуклеозид-5'-фос-фатах фосфатная группа делает этот атом более электроотрицательным, чем в нуклеозиде, что повышает стабилизирующий эффект.
Наряду с хим. св-вами, общими со св-вами нуклеозидов, нуклеотиды характеризуются рядом особенностей. В присут. конденсирующих реагентов (напр., карбодиимидов) нуклеозид-монофосфаты способны претерпевать внутримол. этерифи-кацию (фосфорилирование) с образованием циклических 3',5'- или 2',3'- или же межмол. дегидратацию, приводящую, в зависимости от условий, к динуклеозидпирофосфатам или продуктам олиго- и поликонденсации (олиго- и полинуклео-тидам). Действие аналогичных реагентов превращает нуклеозидтрифосфаты в циклич. триметафосфаты. Фосфорилирование по своб. гидроксилам или имеющимся остаткам фосфорной к-ты приводит к разл. полифосфатам. Фосфатная группа в нуклеотидах может быть отщеплена действием ферментов (фосфатаз), что приводит к нуклеозидам, проалкилирована (наряду с N-атомами) с образованием преим. моноэфиров нуклеотидов или же превращена в фосфамидную группу. Нуклеотиды-мономерные звенья и промежут. продукты биосинтеза нуклеиновых кислот и нуклеотидкоферментов, участники мн. др. процессов в обмене в-в, исходные в-ва для хим. и хим.-ферментативного синтеза олиго- и полинуклеотидов. Они широко применяются в биол. исследованиях. Так, мн. нуклеозид-5'-трифосфаты, модифицированные по моносаха-ридному остатку (с заменой гидроксила в положении У на атом Н, др. атом или группу), включаются с помощью полимераз в цепь нуклеиновой к-ты, обрывая ее рост (терминация цепи). Благодаря этому такие нуклеотиды широко используют при выяснении первичной структуры нуклеиновых к-т (метод Сенгера). Нуклеозид-5'-трифосфаты во мн. случаях являются био-активир. формами физиологически активных нуклеозидов; последние благодаря отсутствию заряда эффективнее проникают через клеточную мембрану и, т. обр., служат ср-вом доставки нуклеотидов в клетку. Нек-рые нуклеотиды, напр. АТФ, применяют в медицине. Циклические нуклеотиды
Нуклеотиды, в молекулах которых остаток фосфорной кислоты, связываясь с углеродными атомами рибозы в 5' и 3' положениях, образует кольцо; универсальные регуляторы биохимических процессов в живых клетках. Наиболее изучен циклический 3', 5'-аденозинмонофосфат (цАМФ) — белый порошок, хорошо растворимый в воде. цАМФ открыт в 1957 американским биохимиком Э. Сазерлендом с сотрудниками при исследовании механизма активации фермента фосфорилазы печени гормонами глюкагоном и адреналином. В тканях животных и человека цАМФ служит посредником в осуществлении многообразных функций различных гормонов и др. биологически активных соединений (некоторых медиаторов, токсинов, лактинов). У бактерий при недостатке в среде легкоусвояемых соединений, например глюкозы, увеличивается содержание цАМФ в клетке, что приводит к биосинтезу адаптивных (индуцируемых) ферментов, необходимых для усвоения др. источников питания. Уровень цАМФ в клетках сальмонеллы Salmonella thyphimurium определяет будущее попавшего в неё фага (при высокой концентрации цАМФ происходит Лизогенизация культуры бактерий, при низкой — фаг вызывает её Лизис). У миксоамёбы Dictyostelium discoideum цАМФ играет роль аттрактанта, привлекающего клетки друг к другу. У высших растений цАМФ опосредует влияние Фитохрома на синтез пигментов бетационинов (у Amaranthus paniculatus). Концентрация цАМФ в тканях млекопитающих очень мала и составляет десятые доли микромоля на 1 кг сырой ткани (10-7—10-6 моль). При активации аденилатциклазы, катализирующей биосинтез цАМФ, или блокировании фосфодиэстеразы, осуществляющей гидролиз этого нуклеотида, концентрация цАМФ в клетке быстро увеличивается. Т. о., содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый «посредник») и цАМФ (второй «посредник») осуществляет т. н. аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, во многих случаях активизирует аденилатциклазу, которая катализирует биосинтез цАМФ. Концентрация цАМФ, образующегося т. о. в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цАМФ в тканях животных и человека лежит его взаимодействие с протеинкиназами — ферментами, активность которых проявляется в присутствии этого нуклеотида. Связывание цАМФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в т. ч. ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. Например, при действии адреналина на клетки печени происходит фосфорилирование двух ферментов — фосфорилазы и гликогенсинтетазы. Фосфорилаза при этом активируется, что приводит к быстрому гидролизу гликогена — запасного вещества печени. Одновременно с началом гидролиза гликогена прекращается его новый синтез, т.к. фермент, участвующий в его образовании, — гликогенсинтетаза при фосфорилировании его протеинкиназами теряет свою активность. Один и тот же гормон, действуя через посредство цАМФ, в разных тканях вызывает различные функциональные ответы, зависящие от особенностей данной ткани. При стрессе, когда потребность в энергии очень велика, мозговой слой надпочечников в повышенном количестве образует гормон адреналин. В печени адреналин обусловливает активное расщепление (фосфоролиз) гликогена, образование фосфорных эфиров глюкозы и выброс в кровь большого количества глюкозы, в жировой ткани — приводит к гидролизу липидов, достигнув сердца, — увеличивает силу сокращения сердечной мышцы, усиливает кровообращение и улучшает питание тканей, осуществляя мобилизацию всех сил организма. цАМФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др. Некоторые медиаторы, например ацетилхолин, могут ускорять образование др. Ц. н. — 3',5'-гуанозинмонофосфата (цГМФ), который синтезируется в клетке из гуанозинтрифосфата при активации фермента гуанилатциклазы, входящей в гуанилатциклазный комплекс, расположенный в клеточной мембране. Характерно, что многие эффекты цГМФ прямо противоположны эффектам цАМФ. Антагонистические отношения Ц. н. проявляются чаще всего в сложных системах, когда для регуляции клеточной функции требуется разновременная модификация многих белков, осуществляемая согласованным действием попеременно активируемых цАМФ- и цГМФ-зависимых протеинкиназ. У бактерий цАМФ, соединившись с неферментным рецепторным белком, присоединяется к ДНК и позволяет ферменту РНК-полимеразе начать транскрипцию гена, ответственного за синтез индуцируемого фермента. Т. о., механизм действия цАМФ у бактерий и в тканях животных и человека принципиально различен. Исследования роли Ц. н. в живых клетках — одно из наиболее быстро развивающихся направлений в биохимии, уже внёсшее существенный вклад в понимание механизмов биологической регуляции на молекулярном уровне. Коферменты Коферменты– это небелковые компоненты сложных ферментов, которые проявляют высокую химическую активность и входят в состав активных центров сложных ферментов. Классификация коферментов. 1.По химической природе: 1. витаминные 2. витаминоподобные 3. невитаминные. 2. По механизму действия: 1. переносчики атомов водорода, электронов и протонов. 2. переносчики отдельных химических групп. Коферменты І группы переносчики атомов водорода, электронов и протонов: А. Невитаминные: гем, глутатион, Б. Витаминные: аскорбиновая кислота (АК), НАД и НАДФ, ФАД и ФМН, 5-дезоксиаденозилкобаламин. В. Витаминоподобные: убихинон (коэнзим Q), липоєвая кислота (ЛК), тетрагидробиоптерин (ТГБП), хиноновые коферменты. Коферменты ІІ группы (переносчики различных химических групп): А. Невитаминные: фосфаты нуклеозидов, фосфаты углеводов. Б. Витаминные: ТДФ, КоА, ПАЛФ, биоцитин, ТГФК, метилкобаламин, витамины К и А
2) переносчики отдельных химических групп. Коферменты І группы переносчики атомов водорода, электронов и протонов: А. Невитаминные: гем, глутатион, Б. Витаминные: аскорбиновая кислота (АК), НАД и НАДФ, ФАД и ФМН, 5-дезоксиаденозилкобаламин. В. Витаминоподобные: убихинон (коэнзим Q), липоєвая кислота (ЛК), тетрагидробиоптерин (ТГБП), хиноновые коферменты. Коферменты ІІ группы (переносчики различных химических групп): А. Невитаминные: фосфаты нуклеозидов, фосфаты углеводов. Б. Витаминные: ТДФ, КоА, ПАЛФ, биоцитин, ТГФК, метилкобаламин, витамины К и А Гем- транспортирует электроны. Структуру гема составляет суперкольцо протопорфири- на ІХ, которое состоит из 4 пирольних колец, соединенных метиновыми (-СН-) мостиками; 4-х метильных (-СН3) групп, 2-х винильных групп и 2-х остатков пропионовой кислоты. В центре протопорфиринового ядра находится атом Fе2+. Механизм действия: Благодаря наличию в составе гема атома железа, ферменты содержащие гем способны транспортировать электроны. При этом железо переходит из двухвалентной формы в трехвалентную форму и наоборот: Биологическая роль: гем входит в состав гемсодержащих ферментов: цитохромов (ферменты тканевого дыхания и микросомального окисления), ферментов каталазы и пероксидазы. Никотинамидные коферменты:Это производные витамина РР, которые используется ферментами – оксидоредуктазами. Наиболее известными являются НАД (никотинамидадениндинуклеотид) и НАДФ (никотинамидадениндинуклеотидфосфат). Функция НАД и НАДФ состоит в переносе атомов водорода и электронов (эта реакция осуществляется за счет никотинамидной части молекул коферментов). В качестве примера рассмотрим обратимую реакцию превращения лактата в пируват с участием НАД-зависимого фермента лактатдегидрогеназы (ЛДГ): Роль НАД и НАДФ очень велика. Укажем на некоторые процессы, которые идут с уча-стием НАД и НАДФ-зависимых дегидрогеназ: 1) гликолиз (аэробный, анаэробный); 2) декарбоксилирование кетокислот; 3) пентозофосфатный цикл (в нем идет синтез НАДФН2); 4)цикл трикарбоновых кислот; 5) -окисление и синтез жирных кислот; 6) синтез и гидроксилирование холестерина и стероидов; 7) гидроксилирование ксенобиотиков. Некоферментные функции: Моно-АДФ-рибозилированиебелков – это присоедине- ние к белкам одного остатка АДФ-рибозы. Эта реакция вызывает изменению активности ферментов и регуляторных белков (белки мышц, АТФ-аза, альдегиддегидрогеназа и другие). Холерный и дифтерийный токсины имеют АДФ-рибозилтрансферазную активность, с чем и связана их высокая токсичность для организма. НАД + Белок = АДФ-рибоза-белок + никотинамид Поли-АДФ-рибозилированиебелков клеточных ядер (гистонов, факторов транскрип- ции) необходимо для регуляции експресии генов, дифференциации клеток. НАД служит источником цикло-АДФ-рибозы, который стимулирует выход кальция и запускает процессы, зависимые от кальция в клетке. Флавиновые коферментысодержат витамин В2 - рибофлавин, который имеет желтый цвет, поэтому они были названы желтыми коферментами. Главными коферментами являются ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид). Особен- ностью их структуры является то, что они содержат производное рибозы – спирт рибитол .Действующая часть кофермента – флавин (в его основе лежит кольцо изоаллоксазина). Механизм действия ФАД и ФМН состоит в переносе атомов водорода (протонов и электронов). ФАД входит в состав ферментов - флавопротеинов, которые катализируют большое количество разных типов реакций. Выделяют три главных типа реакций: 1) Флавиновые ферменты осуществляют обратимую реакцию дегидрирования (отщепленияприсоединения атомов водорода) от субстрата. 2) Флавиновые коферменты катализируют перенос атомов водорода (электронов и протонов) в дыхательной цепи митохондрий, забирая их от восстановленных никотинамидных коферментов (в процессе биологического окисления). 3) Флавиновые коферменты участвуют в свободно-радикальных реакциях. Именно флавиновые коферменты в дыхательной цепи митохондрий, являются основным источник супероксидного радикала и пероксида водорода. ФАД + ФАДН2 → ФАДН.(семихинонный флавиновый радикал) ФАДН. + О2 + Н+→ ФАД + Н2О2 ФМН и ФАД входят в состав многих ферментов - сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза, оксидаза D-аминокислот, моноаминоксидаза. Флавиновые ферменты принимают участие в β-окислении жирных кислот, в окислении спиртов, альдегидов, глюкозы, аминов, глицерина, пуринов (ксантина, гипоксантина, 6-метилпурина), производных никотина, хинолина, НАДН и НАДФН, амида липоевой кислоты. ФАД участвует в работе пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов, в окислении ксенобиотиков. Например, моноаминоксидаза окисляет биогенные амины – гормоны и нейромедиаторы до соответствующих альдегидов: В реакциях, которые протекают с участием кислорода, флавопротеины переносят атомы водорода непосредственно на кислород, что ведет к образованию пероксида водорода. Такие флавопротеины относят к оксидазам (аэробным дегидрогеназам) – моноаминоксидаза, ксантиноксидаза.
Поиск по сайту: |