 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Предложите способы увеличения выхода продуктов данной химической реакции. ⇐ ПредыдущаяСтр 3 из 3
Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье. 1) увеличить температуру системы, т.к. процесс эндотермический (∆r H0Т > 0), в соответствии с изобарой Вант-Гоффа: (dlnKp /dT) = ∆r H0Т /(RT2) ; 2) увеличить концентрацию (парциальное давление) исходного газа СО2 - дополнительный ввод газа; снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции; 3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ. ЗАДАЧА 4. Химическая кинетика. Для заданной химической реакции nА + mВ ® AnBm
1. Рассчитайте энергию активации по значениям констант скорости реакции k1 и k2 при температурах Т1 и Т2 , соответственно. Дайте определение и предложите способы изменения энергии активации. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная. Для заданной химической реакции: ln(2 .10-1/5 .10-5)=Еакт . (400 - 330 ) / 8,31. 400 . 330, решаем уравнение и получаем: Еакт =130 кДж/моль. Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора. 2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре Т2 , если начальная концентрация реагентов одинакова и равна С0 . По размерности константы скорости химической реакции, [ k ] = [л2×моль-2×с-1] , определяем порядок химической реакции: n=3. Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:
где с – текущая концентрация веществ в момент времени τ, с0 – начальная концентрация веществ, k – константа скорости, τ – время. Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К, k2= 2 .10-1 л2×моль-2×с-1:
решаем уравнение и получаем: с = 0,035 моль/л. Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К: Δс = с0 - с = 0,1- 0,035= 0,065 моль/л.
Поиск по сайту: |


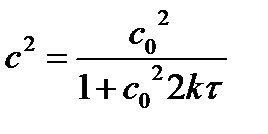
 ,
,