 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЗАДАЧА 2. Химическое равновесие.
Для химической реакции СO2 (г) + C(к) « 2CО(г) 1. Рассчитайте энергию Гиббса DrG0Т и константу равновесия Кр данной реакции при стандартном состоянии и температурах 298 К, 500 К, 800 К, 1000 К с учетом зависимости Dr H0Т и Dr S 0Т от температуры при постоянной величине удельной теплоемкости веществ ср=const . Постройте график зависимости Кр = f (Т ). Рассчитаем изменение теплоемкости системы (∆ rc0р = const): ∆r с0 р= 2с0р 298СОг – с0р 298Ск – с0р 298СО2г = = 2.(29,14)–8,54–37,41 =12,33 Дж/К. Рассчитаем энергию Гиббса химической реакции при стандартном состоянии и заданных температурах 298 К, 500 К, 800 К, 1000 К с учетом зависимости ∆r H0Т и ∆r S0Т от температуры, считая постоянной величину удельной теплоемкости веществ ср , по формуле: ∆r G0T = ∆r H0Т – Т.∆r S0Т = ∆r G0298 + ∆rс0р(Т - 298)–Т.∆r с0р ln (Т/ 298). ∆r G0298=120,15 кДж; ∆r G0500=120,15+12,33.10-3 . (500-298) - 500.12,33.10-3 . ln (500/298)= =84,67кДж; ∆r G0800=120,15+12,33.10-3 . (800-298) - 800.12,33.10-3 . ln (800/298)= =31,97кДж; ∆r G01000 =120,15+12,33.10-3 . (1000-298) - 1000.12,33.10-3 . ln (1000/298) = = -3,16 кДж. Термодинамическое условие химического равновесия: ∆rGT = 0. Энергия Гиббса химической реакции при стандартном состоянии ∆r G0Т связана с константой равновесия Кр по соотношению: ∆r G0Т = - RTlnКр Рассчитав величину ∆r G0T реакции , рассчитаем константу равновесия Кр по формуле: Kp = exp(-∆G0Т /RT) , где R=8,31 Дж/моль.К - универсальная газовая постоянная. Kp,298 = exp(-∆G0Т, 298 / R. 298) = exp( -120,15/8,31.10-3.298) =8.10-22; Kp,500 = exp(-∆G0Т, 500 / R. 500) = exp(-84,67/8,31.10-3.500) =1,4.10-9; Kp,800 = exp(-∆G0Т, 800/ R. 800) = exp(-31,97/8,31.10-3.800) =8,1.10-3; Kp,1000 = exp(-∆G0Т, 1000 / R. 1000) = exp(3,16/8,31.10-3.1000) =1,46. При увеличении температуры увеличивается константа равновесия, что объясняется эндотермическим тепловым эффектом данной реакции
2. Выберите любую температуру из области самопроизвольного протекания реакции в прямом направлении. При этой температуре рассчитайте равновесные концентрации газообразных реагентов, если их исходные концентрации были равны, соответственно, ( см. п.3. табл. к задачам 1,2). При Т=1000 К реакция протекает самопроизвольно в прямом направлении, т.к. ∆r G01000 = - 3,16 кДж <0, Kp,1000 = 1,46. Выберем температуру Т=1000 для расчета равновесных концентраций газообразных реагентов, если исходные концентрации газообразных реагентов СО2 и СО были равны: сСО2 = 0,5 моль/л, сСО =0. Выражения для констант равновесия, выраженных через относительные равновесные парциальные давления газов (рравн) и равновесные концентрации (сравн) : Кр =
Kp и Kс связаны через уравнение газового состояния: Kс,1000 = где R=0,082 л.атм/моль.К - универсальная газовая постоянная; ∆ν = 2-1= 1 (изменение числа молей газообразных веществ в ходе реакции). Таблица материального баланса:
Подставляем равновесные концентрации газообразных реагентов в выражение для Kс и решаем алгебраическое уравнение относительно х : Кс = ССО равн = 2. 0,0387 = 0,0774моль/л ССО2равн = 0,5 - 0,0387 = 0,4613 моль/л.
Поиск по сайту: |

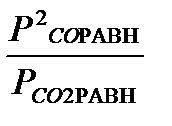 ; Кс =
; Кс = 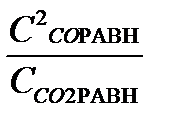
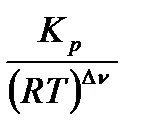 =
=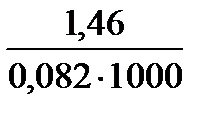 = 0,018
= 0,018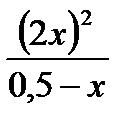 = 0,018 , х = 0,0387моль/л
= 0,018 , х = 0,0387моль/л