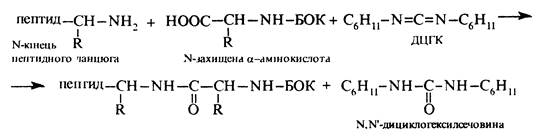|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
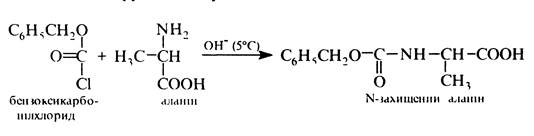
Захист аміногрупи аланіну ⇐ ПредыдущаяСтр 3 из 3
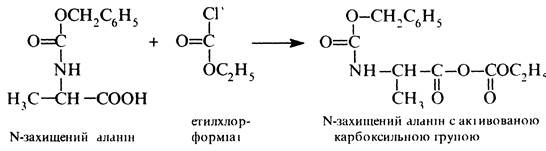
Активація карбоксильної групи Н-захищеного аланіну
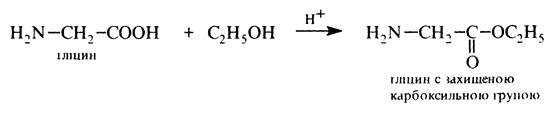
Захист карбоксильної групи гліцину
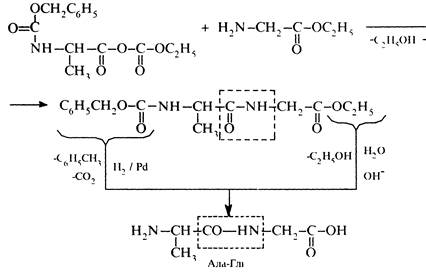
Утворення пептидного зв'язку та зняття захисту
Синтез пептидів за наведеною схемою досить складний та трудоємкий. У 1962 р. Б.Меррифілдом був запропонований більш досконалий метод добування пептидів, так званий твердофазний синтез. Суть останнього полягає в тому, що поліпептидний ланцюг доточується на твердому носії без виділення проміжних продуктів синтезу. Пептид, фіксований на носії, після кожної стадії ретельно відмивають від надлишку реагентів і побічних продуктів. Відщеплюють кінцевий продукт від носія за допомогою суміші бромоводневої та трифтороцтової кислот. В якості твердого носія використовують зерна полімерної смоли, що містить хлорметильні (-СН2С1) групи, котрі називають якірними групами, з якими реагує карбоксильна група N-захищеної a-амінокислоти. В результаті взаємодії відбувається фіксація С-кінця майбутнього поліпептиду на поверхні носія. Аміногрупу, як правило, захищають трет-бутоксикарбонільною групою (БОК), яка легко видаляється дією трифтороцтової кислоти. Пептидний зв'язок утворюється в присутності активатора карбоксильної групи — N,N'-дициклогексилкарбодііміду (ДЦГК) — C6H11-N=C=N-C6H11. Широке застосування цієї речовини пов'язане з легкістю добування, простотою застосування, а також швидкістю та ефективністю проходження реакції конденсації в його присутності.
Тепер твердофазний синтез пептидів проводять у спеціальних синтезаторах, де всі етапи здійснюються автоматично з запрограмованою подачею відповідних a-амінокислот.
БІЛКИ (ПРОТЕЇНИ)
Залежно від структури білки поділяють на прості (протеїни) та складні (протеїди). Останні, крім білка, містять у своїй структурі хімічно зв'язану з ним простетичну групу небілкову частину молекули. За природою простетичної групи протеїди ділять на ліпопротеїди, нуклеопротеїди, глікопротеїди, хромопротеїди, фосфопротеїди та мета металопротеїди. Ліпопротеїди в якості простетичної групи містять ліпіди, нуклеопротеїди - нуклеїнові кислоти, глікопротеїди - вуглеводи, хромопротеїди - пігменти, фосфопротеїди - фосфорну кислоту, металопротеїди - метали. Існують також складні білкові комплекси, до складу котрих водночас входять білки, ліпіди та вуглеводи, звані гліколіпопротеїдами. Вони містяться в сполучній тканині, клітинних стінках бактерій та ін. У залежності від просторової форми молекул білки поділяють на глобулярні та фібрилярні. Глобулярні білки мають сферичну або еліпсоїдну форму, фібрилярні - складаються з витягнутих ниткоподібних макромолекул, які називають протеноїдами. Глобулярні білки (альбумін, глобулін) малостійкі до дії температури, кислот і лугів, а фібрилярні (білки волосся, нігтів, епідермісу; сполучної, кісткової, хрящової тканин та ш.) вельми стійкі. Під впливом багатьох факторів (підвищена температура, зміна рН середовища, УФ- і у-випромінювання та ін.) відбувається руйнування просторової форми білків при збереженні первинної структури. Цей процес називають денатурацією білка. Денатурація є, як правило, оборотним процесом і призводить до втрати біологічних функцій білків. Прикладом теплової денатурації є «зсідання» яєчних білків при варці яєць. При денатурації відбувається розрив водневих зв'язків, які стабілізують просторову форму білка. Денатурований білок втрачає розчинність, у результаті чого первісна просторова форма його не може бути відновленою. Денатурацію може також викликати утворення нерозчинних солей білків. Це відбувається при отруєнні солями важких металів (ртуті, свинцю та ін.). Як протиотруту в таких випадках застосовують білки з підвищеним вмістом кислотних груп, наприклад, яєчний альбумін. Виконуючи роль конкурента, ці білки зв'язують метали з утворенням нерозчинних солей, котрі виводяться з організму.
Поиск по сайту: |