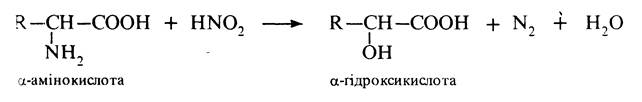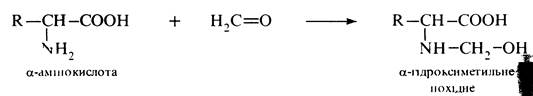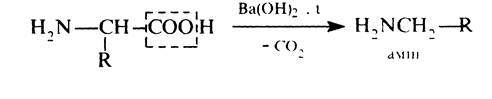|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
A-АМІНОКИСЛОТИ ЯК МОНОМЕРИ БІЛКІВСтр 1 из 3Следующая ⇒
АМІНОКИСЛОТИ
Амінокислотами називають похідні карбонових кислот, у вуглеводневому радикалі яких один або декілька атомів водню заміщені на аміногрупу.
У залежності від природи вуглеводневого радикала, з яким зв'язана карбоксильна група, амінокислоти підрозділяють на аліфатичні й ароматичні. Аліфатичні амінокислоти за взаємним розміщенням аміногрупи та карбоксильної групи поділяють на a-, b-, g-амінокислоти і т. д. Найбільш розповсюдженими в природі є a-амінокислоти, які входять до складу білків.
Номенклатура та ізомерія
За замісниковою номенклатурою ІЮПАК назви амінокислот утворюють з тривіальних або систематичних назв відповідних карбонових кислот та префікса аміно-. У випадку тривіальних карбонових кислот для позначення положення аміногрупи застосовують букви грецького алфавіту a-, b-, g- і т.д., при використанні систематичних назв кислот положення аміногрупи позначають цифровими локантами. Для амінокислот, які входять до складу білків, найчастіше застосовують тривіальні назви. Ароматичні амінокислоти бензольного ряду розглядають як похідні бензойної кислоти:
Способи добування
Існує множина способів добування амінокислот, з яких найважливішими є такі: Дія аміаку на галогенокарбонові кислоти. При взаємодії галогенокарбонових кислот з аміаком атом галогену заміщується на аміногрупу. Через доступність a-галогенокарбонових кислот цей метод в основному застосовується для добування a-амінокислот:
Дія аміаку та ціановодневої кислоти на альдегіди (синтез Штреккера). Цей спосіб застосовується для синтезу a-амінокислот. При взаємодії альдегідів з аміаком спочатку утворюється альдімін, який в присутності ціановодневої кислоти перетворюється на a-амінонітрил. Нітрил, що утворився, легко гідролізується до кислоти:
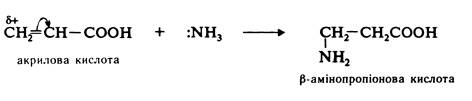
Приєднаня аміаку до на a-, b-ненасичених кислот. При дії аміаку на a-, b-ненасичені кислоти утворюються b-амінокислоти. Приєднання аміаку проходить проти правила Марковникова:
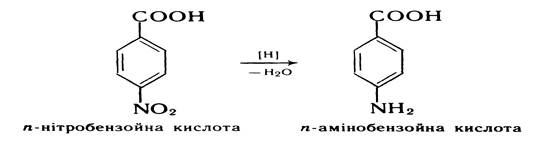
Відновлення нітробензойних кислот. При відновленні нітробензойних кислот за реакцією Зініна утворюються відповідні амінобензойні кислоти:
Фізичні та хімічні властивості
Амінокислоти являють собою білі кристалічні речовини з високими температурами плавлення, добре розчинні у воді. Внаслідок наявності в структурі кислотного центру (група — СООН) та основного центру (група — NH2) амінокислоти кристалізуються з нейтральних водних розчинів у вигляді внутрішніх солей, що дістали назву біполярні іони, або цвіттер-іони:
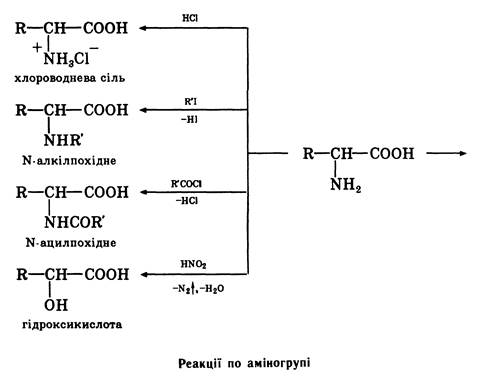
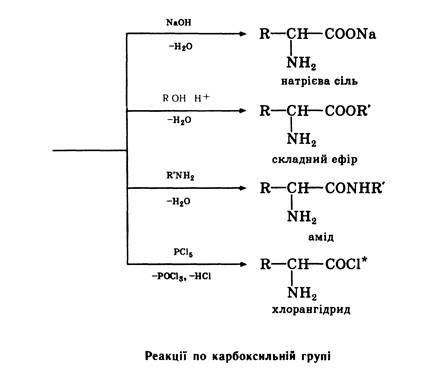
У хімічному відношенні амінокислоти виявляють властивості первинних амінів та карбонових кислот. По карбоксильній групі вони утворюють функціональні похідні карбонових кислот — солі, складні ефіри, аміди, галогенангідриди. За участю аміногрупи амінокислоти утворюють солі з мінеральними кислотами, вступають в реакції алкілування, ацилування, реагують з азотистою кислотою, а також дають інші реакції, властиві первинним амінам. Оскільки амінокислоти утворюють солі як з мінеральними кислотами, так і з основами, вони є амфотерним речовинами. Деякі хімічні перетворення амінокислот представлені на схемах.
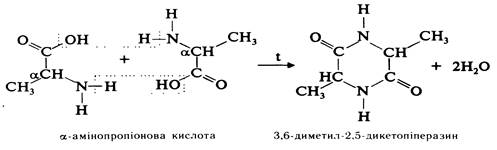
Разом з тим амінокислоти виявляють деякі специфічні властивості, зумовлені взаємним впливом карбоксильної і аміногруп. Відношення амінокислот до нагрівання. При нагріванні a-, b-, g- та δ-амінокислот утворюються різні продукти. a-Амінокислоти при нагріванні зазнають міжмолекулярної дегідратації, утворюючи при цьому циклічний діамід — дикетопіперазин:
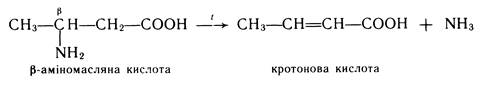
b-Амінокислоти при нагріванні відщеплюють молекулу аміаку, утворюючи a-, b-ненасичені кислоти:
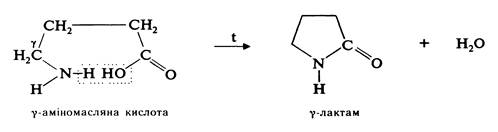
g- та δ-Амінокислоти при нагріванні зазнають внутрішньомолекулярної дегідратації, утворюючи циклічні аміди — лактами:
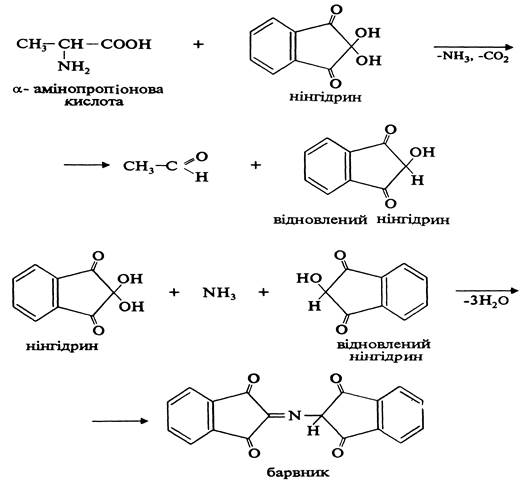
Взаємодія a-амінокислот з нінгідрином. При дії нінгідрину на a-амінокислоти утворюється барвник синьо-фіолетового кольору. Реакція проходить у дві стадії. На першій стадії під дією нінгідрину відбувається окислювальне дезамінування амінокислоти та її декарбоксилування. На другій стадії реакції аміак, що утворився, реагує з еквімолекулярними кількостями звичайного та відновленого нінгідрину, утворюючи барвник синьо-фіолетового кольору:
Нінгідринова реакція використовується для якісного визначен- ня а-амінокислот.
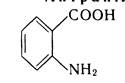
Окремі представники g-Аміномасляна кислота (4-амінобутанова кислота, ГАМК) NН2—СН2—СН2—СН2—СООН. Біла кристалічна речовина (т пл. 202 °С), добре розчиняється у воді. ГАМК утворюється в живих організмах при декарбоксилуванні глутамінової кислоти. Є нейромедіатором, що бере участь в обмінних процесах головного мозку. g-Аміномасляна кислота під назвою аміналон або гамалон широко застостосовується в медицині для лікування нервово-психічних захворювань, при ослабленні пам'яті, порушеннях мозкового кровообігу та ін. ГАМК використовується в синтезі інших лікарських препаратів, наприклад пірацетам, фенібут тощо. ε-Амінокапронова кислота (6-аміногексанова кислота) NH2— СН2— СН2— СН2— СН2— СН2— СООН. Біла кристалічна речовина (т. пл. 372 °С), легко розчиняється у воді. Застосовується в медицині як кровоспинний засіб. Антранілова кислота (о-амінобензойна кислота). кристалічна речовина (т. пл. 145 °С), практично не розчиняється у воді. Застосовується у виробництві барвників і лікарських засобів.
п-Амінобензойна кислота (ПАБК)
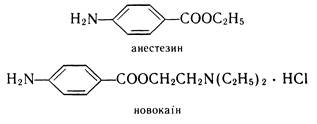
Біла кристалічна речовина (т. пл. 186 °С), мало розчинна у воді. Входить до складу фолієвої кислоти, яка виконує роль фактора росту для деяких мікроорганізмів. Складні ефіри п-амінобензойної кислоти широко застосовуються в медицині як місцевоанестезуючі засоби, наприклад анестезин (етиловий ефір п-амінобензойної кислоти) та новокаїн (b-діетиламіноетилового ефіру п-амінобензойної кислоти гідрохлорид) :
БІЛКИ Білки – основа всього живого. Вони є компонентами всіх клітин тканин живих організмів. До білкових речовин належать ферменти, деякі гормони та ін. Поряд з нуклеїновими кислотами білки являють собою найскладніші зі створених природою біополімерів. Молекулярна маса білків складає від 5000 до багатьох мільйонів. Білки з низькою молекулярною масою називаються пептидами. Мономерними одиницями білків і пептидів є a-амінокислоти.
a-АМІНОКИСЛОТИ ЯК МОНОМЕРИ БІЛКІВ
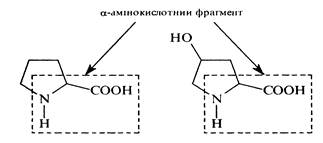
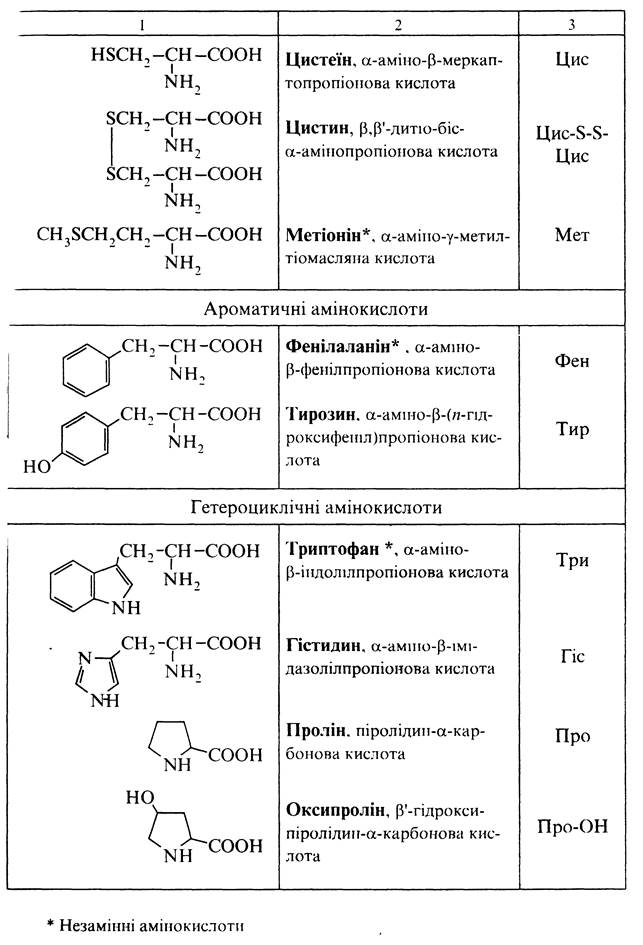
До складу більшості білків входить близько 25 різних a-амінокислот загальної формули R—(NН2)СН—СООН, з яких приблизно 20 присутні в кожній білковій молекулі. Основні a-амінокислоти, що входять до складу білків, подані в таблиці нижче. В номенклатурі a-амінокислот частіше застосовують тривіальні назви: гліцин, аланін, валін, лейцин та ін. У біохімії використовують також трилітерні скорочення тривіальних назв, наприклад: гліцин Глі, аланін Ала, валін Вал. Систематичні назви для природних a-амінокислот практично не застосовують. За хімічною природою залишку, зв'язаного з a-амінокислотним фрагментом СН(NН2)СООН, a-амінокислоти поділяють на аліфатичні, ароматичні та гетероциклічні. У гетероциклічних a-амінокислот проліну та оксипроліну a-амінокислотний фрагмент входить до складу гетероциклу:
У залежності від кількості -NН2 та -СООН груп у молекулі розрізняють a-амінокислоти: моноаміномонокарбонові (гліцин, валін та ін.), моноамінодикарбонові (аспарагінова, глутамінова кислоти та їх аміди) та діаміномонокарбонові (орнітин, лізин, аргінін, гістидин). За кислотно-основними властивостями a-амінокислоти поділяють на нейтральні (містять рівну кількість аміно- та карбоксильних груп), кислі (з додатковою карбоксильною групою) та основні (з додатковою аміногрупою). Більшість a-амінокислот утворюється в організмі (замінні амінокислоти), але деякі a-амінокислоти організм людини нездатний синтезувати; вони надходять у складі білків, які вводяться в організм їжею.
Стереоізомерія Усі a-амінокислоти, за винятком гліцину, містять хіральний a-вуглецевий атом та існують у вигляді пари енантіомерів. Для позначення конфігурацій при хіральному центрі застосовують L та D-систему:
a-Амінокислоти, котрі входять до складу білків тварин і людини мають L-конфігурацію. Амінокислоти D-ряду зустрічаються лише в небілкових компонентах рослин і грибів, а також синтезуються мікроорганізмами. Деякі амінокислоти, наприклад, ізолейцин і треонін, містять по два хіральні центри і можуть існувати у вигляді двох пар енантіомерів; у білках зустрічаються такі їх ізомери:
Використання а-амінокислот L-ряду для біосинтезу білків має найважливіше значення у формуванні їх просторової структури та виявленні біологічної активності. Фізичні властивості a-Амінокислоти являють собою кристалічні речовини, що не мають чітких температур плавлення та розкладаються при температурі вищій 200 °С. Вони не розчинні в неполярних органічних розчинниках, але помітно розчинні у воді. У кристалічному стані та водих розчинах амінокислоти знаходяться у вигляді біполярних іонів (цвіттер-іонів, внутрішніх солей). Можливість утворення останніх пов'язана з амфотерністю амінокислот, зумовленою наявністю в їх молекулі кислотної (СООН) і основної (NН2) груп. У водному розчині a-амінокислоти існують у вигляді рівноважної суміші, яка складається з цвіттер-іонів, катіонної та аніонної форм:
Положення такої рівноваги істотно залежить від рН середовища: в сильнокислому середовищі (рН 1-2) переважає катіонна форма, в сильнолужному (рН 13-14) — аніонна. Якщо розчин амінокислоти помістити в електричне поле, то в кислому середовищі молекули переміщуються до катода (катіонна форма), а в лужному — до анода (аніонна форма). Проте, для кожної амінокислоти існує характерне значення рН, при котрому молекули не переміщуються в електричному полі. При цьому значенні рН, званому ізоелектричною точкою (рІ), амінокислота знаходиться у вигляді цвіттер-іонів і в цілому електронейтральна. Ізоелектрична точка залежить від співвідношення кількостей кислих і основних груп у молекулі: рІ кислих амінокислот має значення менше 7, тому що в кислому середовищі стримується іонізація другої карбоксильної групи та, відповідно, рІ основних амінокислот знаходиться в області більшій 7, бо в лужному середовищі стримується протонування другої аміногрупи.
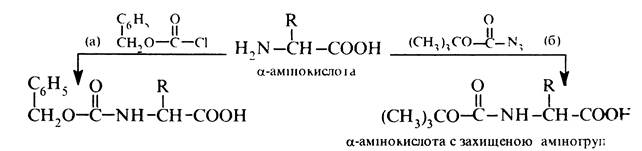
Хімічні властивості a-амінокислот Реакції по аміногрупі Утворення N-ацильниx похідних. При взаємодії a-амінокислот з ангідридами або хлорангідридами карбонових кислот утворюють N-ацильні похідні, котрі відносно легко руйнуються до вихідних a-амінокислот. У зв'язку з цим реакція ацилювання використовуєте для блокування (захисту) аміногрупи при синтезі пептидів. Як ацилюючі реагенти використовують бензоксикарбонілхлорид (а) або трет-бутоксикарбоксазид (б):
Захисну карбобензоксигрупу видаляють каталітичним гідролізом або дією розчину бромоводню в оцтовій кислоті на холоді:
Дезамінування. Під дією азотистої кислоти a-амінокислоти перетвоорюються на відповідні a-гідроксикислоти:
Реакція застосовується в аналітичній практиці (метод Ван-Слайка). За об'ємом азоту, що виділився, визначають кількісний вміст a-амінокислоти. В організмі a-амінокислоти піддаються окисному дезамінуванню. Реакція відбувається під дією ферментів оксидаз і окисного агенту коферменту НАД:
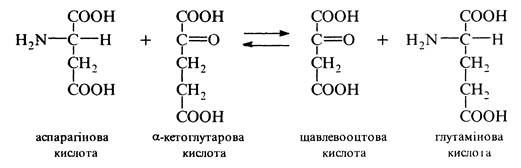
Трансамінування ( пергамінування). Процес проходить тільки в живих організмах. Реакція відбувається за участю ферментів трансаміназ і коферменту піридоксальфосфату між a-аміно- і a-кетокислотами та зводиться до взаємообміну аміно- та карбонільною групами:
Взаємодія з карбонільними сполуками. Формальдегід реагує з a-амінокислотами у водному розчині з утворенням N-гідроксиметильних похідних. Реакцію покладено в основу кількісного визначення a-амінокислот методом формольного титрування за Серенсеном.
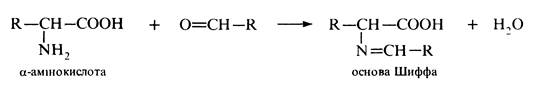
Інші альдегіди та кетони реагують з а-амінокислотами з утворенням основ Шиффа:
Взаємодія з фенілізотіоціанатом (реакція Едмана). При взаємодії a-амінокислот з фенілізотіоціанатом утворюються похідні З-феніл-2-тіогідантоїну. Спочатку в присутності лугу відбувається приєднання фенілізотіоціанату за аміногрупою a-амінокислоти, а потім при нагріванні продукту приєднання в присутності мінеральної кислоти відбувається циклізація з утворенням похідного фенілтіогідантоїну (ФТГ-похідного):
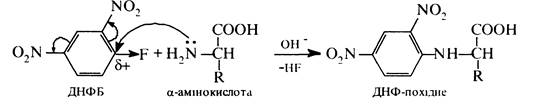
Реакція використовується для установлення будови пептидів (деградація за Едманом). Взаємодія з 2,4-динітрофторбензолом (реактив Сетера). При взаємодії a-амінокислот з 2,4-динітрофторбензолом (ДНФБ) утворюється N-динітрофенільне похідне (ДНФ-похідне):
Реакція проходить за механізмом нуклеофільного заміщення. Використовується для визначення будови пептидів.
Реакції по карбоксильній групі
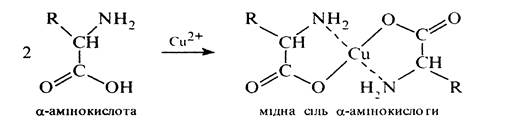
Утворення хелатних сполук. Характерною особливістю a-амінокислот є здатність утворювати міцні хелати комплексні солі з іона важких металів, наприклад:
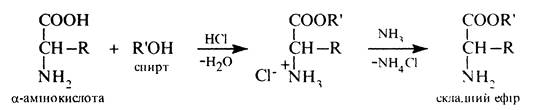
Незначна розчинність та інтенсивне забарвлення хелатів міді (II) дозволяє використовувати їх в аналітичній практиці для виявлення a-амінокислот. Утворення складних ефірів. Як карбонові кислоти a-амінокислоти при взаємодії зі спиртами утворюють складні ефіри:
Складні ефіри a-амінокислот розчинні в органічних розчинниках, леткі та добре переганяються. Ці властивості їх використовуються при розділенні суміші a-амінокислот у білкових гідролізатах. З цією метою a-амінокислоти спочатку етерифікують, а потім одержані ефіри піддають перегонці. Для розділення суміші складних ефірів a-амінокислот нині застосовують метод газо-рідинної хроматографії (ГРХ). Ця реакція служить також зручним методом захисту карбоксильної групи при синтезі пептидів.
Утворення галогенангідридів і ангідридів. Аналогічно карбоновим кислотам, a-амінокислоти утворюють галогенангідриди та ангідриди. Перед проведенням реакції спочатку захищають аміногрупу утворенням N-ацильних похідних. Декарбоксилювання. У зв'язку з наявністю біля a-вуглецевого атома двох сильних електроноакцепторних груп карбоксильної та аміногрупи a-амінокислоти відносно легко декарбоксилюються:
Ідентифікація a-амінокислот Нінгідринна реакція. Для виявлення a-амінокислот використовується реакція з нінгідрином, в результаті котрої утворюється продукт, забарвлений в синьо-фіолетовий колір з максимумом поглинання при 570 нм:
Нінгідриновий реактив застосовується в хроматографічному аналізі для проявлення хроматограм на папері та в тонкому шарі сорбенту, а також для кількісного колориметричного визначенні a-амінокислот.
Ксантопротеїнова реакція. Це реакція з концентрованою азотною кислотою на a-амінокислоти, що містять у своїй молекулі ароматичні цикли. В результаті останньої відбувається нітрування ароматичного циклу з утворенням нітропохідного, забарвленого у жовтий колір.
Поиск по сайту: |
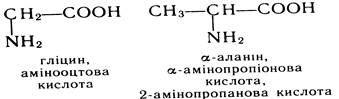
 Ізомерія Ізомерія амінокислот може бути зумовлена різною структурою вуглеводневого радикала, з котрим сполучена карбоксильна група, та різним положенням аміногрупи у вуглецевому ланцюзі (структурна ізомерія); для амінокислот, що містять асиметричний атом вуглецю, ізомерія пов'язана з різним розміщенням замісників у просторі (оптична ізомерія).
Ізомерія Ізомерія амінокислот може бути зумовлена різною структурою вуглеводневого радикала, з котрим сполучена карбоксильна група, та різним положенням аміногрупи у вуглецевому ланцюзі (структурна ізомерія); для амінокислот, що містять асиметричний атом вуглецю, ізомерія пов'язана з різним розміщенням замісників у просторі (оптична ізомерія).


 Біла
Біла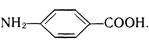 .
.

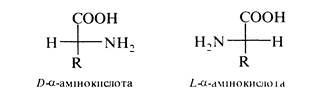

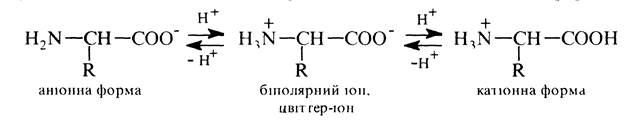
 Трет-бутоксикарбонільну групу руйнують дією трифтороцтової кислоти:
Трет-бутоксикарбонільну групу руйнують дією трифтороцтової кислоти: