|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
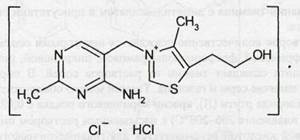
Thiamine Chloride — тиамина хлорид ⇐ ПредыдущаяСтр 4 из 4
4-метил-5 (J-оксиэти n-N-(2|-метил-4'-амино-5| -метилпиримидил)-тиазолий хлорида гидрохлорид Белый кристаллический порошок со слабым характерным запахом, напоминающим запах дрожжей. Гигроскопичен. Они представляют собой белые или с желтоватым оттенком кристаллические вещества со слабым характерным запахом. Тиамина хлорид отличается несколько более высокой гигроскопичностью. Оба легко растворимы в воде, мало растворимы в этиловом спирте и практически нерастворимы в эфире и хлороформе. Они являются двойными солями, образование которых обусловлено наличием четвертичного азота тиазолового цикла и основными свойствами пиримидинового цикла. Водные растворы (5-6%-ные) имеют рН 2,7-3,ff" Идентификация. Подлинность солей тиамина можно подтвердить по ИК- и УФ-спектрам. ИК-спектр тиамина хлорида, полученный после прессования в таблетке из бромида калия в области 4000-700 см-1 должен полностью совпадать с рисунком спектра, прилагаемым к ФС. УФ-спектр 0,0015%-ного раствора тиамина бромида в 0,1 М растворе хлороводородной кислоты в области 220-280 нм имеет один максимум поглощения при 246 нм, а 0,0025%-ного водного раствора тиамина хлорида — два максимума поглощения при 237 и 262 нм. Кроме измерений ИК- и УФ-спектров для испытания подлинности используют химические реакции: окисления в щелочной среде, деструкции при сплавлении со щелочами (до образования сульфид-ионов), образования азокрасителя за счет подвижного атома водорода в положении 2, нейтрализации связанных кислот, обнаружения бромид- или хлорид-ионов, реакций с «осадительными» реактивами. Идентифицируют обе соли с помощью реакции, основанной на окислении тиамина в щелочной среде. Эта реакция известна под названием тиохромной пробы. Общая ее схема:
Тиохром из водных растворов извлекают бутиловым или изоамиловым спиртом. Полученные спиртовые растворы при ультрафиолетовом облучении (365 нм) имеют характерную синюю флуоресценцию, исчезающую при подкислении и вновь возникающую при подщелачивании. Реакцию образования тиохрома используют для количественного флуориметрического определения тиамина. Тиамина бромид дает характерные реакции на бромиды, а тиамина хлорид — на хлориды. Реакция образования свободного брома под действием хлорамина в солянокислой среде (желто-бурое окрашивание хлороформного слоя) рекомендована ФС для отличия тиамина бромида от тиамина хлорида. При действии на соли тиамина реактивом Несслера появляется желтое окрашивание, которое вследствие восстановления до металлической ртути переходит в черное. При добавлении двух капель 15%-ного раствора гидроксида натрия к 0,1 %-ному раствору соли тиамина появляется желтое окрашивание. При сплавлении с кристаллическими едкими щелочами тиамин разрушается с образованием сульфидов, которые легко обнаружить с помощью раствора нитропруссида натрия (красно-фиолетовое окрашивание). Как и другие третичные амины, тиамин при нагревании на водяной бане с уксусным ангидридом и кристаллами лимонной кислоты приобретает красное окрашивание. При пиролизе тиамина вследствие наличия в его молекуле первичной аминогруппы происходит конденсация:
Благодаря этому при нагревании тиамина с диметилоксалатом в присутствии тиобарбитуровой кислоты образуется вещество красного цвета. Основание тиамина из растворов количественно осаждается некоторыми осадительными (общеалкалоидными) реактивами (кремневольфрамовой, фосфорновольфрамовой, пикриновой, пикролоновой кислотами и др.). Фосфорновольфрамовая кислота осаждает тиамин из растворов солей. В образовавшемся фосфорно-вольфрамате затем обнаруживают наличие серы и галогена. Тиамин можно обнаружить по образованию белого осадка с насыщенным раствором хлорида ртути (II), красно-коричневого осадка с 0,02 М раствором иода, желтого осадка пикрата (температура плавления 206-208°С) с насыщенным раствором пикриновой кислоты. Реакция осаждения кремневольфрамовой кислотой рекомендуется для гравиметрического и фотонефелометрического определения солей тиамина. Кремневольфрамат тиамина имеет состав: 2[Ci2H|7BrN4OS]-SiO2l2WO3.
Поиск по сайту: |