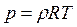|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тепловий вибух в неадіабатичних умовах ⇐ ПредыдущаяСтр 3 из 3
У реальних системах завжди відбуваються втрати теплоти за рахунок теплопровідності через стінки, конвекції, випромінювання і т.д. При цьому екзотермічна реакція буде або прискорюватися, призводячи до вибуху, або протікати з постійною швидкістю при постійній температурі T=const, яка визначається тепловим балансом системи. Так, зокрема, протікають екзотермічні реакції горіння в газових печах, котельних топках та інших теплотехнічних агрегатах. При наявності теплових втрат рівняння (2.2) набуде вигляду
де V - об'єм реактора; S - площа поверхні стінок реактора; Tс - температура стінок реактора; α - коефіцієнт теплопередачі. Перша складова різниці в правій частині рівняння (2.5) описує швидкість виділення тепла в системі за рахунок хімічної реакції. Друга складова - швидкість відводу тепла за рахунок теплопровідності стінок, яка лінійно залежить від температури реагуючої суміші. Швидкість припливу тепла зростає по статичному закону із зростанням початкової концентрації компонентів Позначимо через
D1 > Dкр > D2. З аналізу наведених графіків, які представляють собою діаграму Семенова, випливає, що при D = D1, криві Q +, Q-не мають точок перетину; при D = Dкр, криві Q+, Q-мають одну точку дотику; при D = D2, криві Q +, Q-мають дві точки перетину. У першому випадку (D = D1) швидкість тепловиділення завжди перевищує швидкість тепловтрат, і в системі обов'язково відбудеться тепловий вибух, так як температура суміші буде необмежено зростати. Другий випадок (D = Dкр), коли має місце торкання кривих тепловиділення і тепловтрат, визначає максимальне значення концентрації реагентів (параметра D), при якому швидкість тепловиділення дорівнює швидкості тепловтрат.
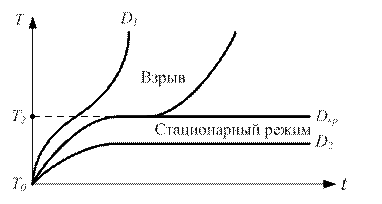
Рис. 2.8. Вплив температури неадіабатичної системи на швидкість тепловиділення та швидкість тепловтрат Всі інші криві Q + для більш низьких значень концентрації реагентів перетинають криву Q-двічі. Причому, стійкому стану системи відповідає лише нижня точка з більш низькою температурою Туст. Таким чином, якщо концентрація реагентів не перевищує певного критичного для даної системи значення, то температура суміші в реакторі буде постійною T = Туст т = const, причому Туст > Тс. При виконанні цієї умови після деякого перехідного періоду в хімічному реакторі встановлюється стаціонарний режим, при якому швидкість екзотермічної реакції буде мати постійне значення u = const. На рис. 2.9 наведено три режими роботи реактора у вигляді залежності температури від часу T = f(t).
Рис. 2.9. Режими роботи реактора Температура Т2 відповідає максимальній температурі в реакторі, при якій можливо стійке протікання хімічної реакції (при заданих значеннях С1, С2, Тс). Можна показати,що величина Т2 визначається формулою
Температура Т2 пов'язана з параметрами реактора наступним співвідношенням:
Це рівняння дозволяє визначити вибухобезпечність кожного конкретного реактора. Позначимо Z1 =
Якщо Z2 << Z1, то реактор вибухобезпечний, якщо Z2 » Z1, то ситуація є критичною,тобто можна очікувати вибуху; при Z2 > Z1 в реакторі обов'язково відбудеться тепловий вибух. Для розрахунку тиску в реакторі по відомій швидкості зростання температури dT/dt використовується рівняння стану (рівняння Менделєєва-Клапейрона)
де p, r, T, R - тиск, щільність, абсолютна температура і газова постійна продуктів згоряння в реакторі. Газова постійна продуктів згоряння R розраховується за формулою R = cp – cv, де cp, cv - питомі теплоємності продуктів згоряння при постійному тиску і постійному об’ємі, відповідно.
Поиск по сайту: |
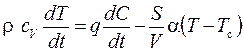
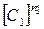 ,
, 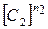 і експоненціально зростає із зростанням температури T відповідно до закону Арреніуса.
і експоненціально зростає із зростанням температури T відповідно до закону Арреніуса. графіки залежності швидкості тепловиділення Q + і швидкості тепловтрат Q-від температури Т, які наведені на рис. 2.8 для трьох значень D:
графіки залежності швидкості тепловиділення Q + і швидкості тепловтрат Q-від температури Т, які наведені на рис. 2.8 для трьох значень D: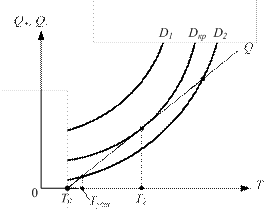

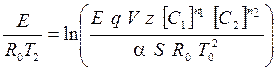
 ,
,