|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ОСНОВНІ ПОНЯТТЯ ХІМІЧНОЇ КІНЕТИКИСтр 1 из 3Следующая ⇒
ЗАГОРАННЯ Горіння всіх речовин починається з їх займання. У більшості горючих речовин момент займання характеризується появою полум'я. У тих речовин, які горять без полум'я, наприклад, у термітних складів, які використовуються для зварювання металів, момент займання характеризується появою свічення. Відомі два види займання речовин – самозаймання і запалювання (вимушене займання). При самозаймання рівномірно нагрівається вся горюча суміш. При запаленні використовується явище розповсюдження фронту полум'я від місцевого відносного невеликого за розмірами джерела запалювання (полум'я, іскра, і т.п.). Таким чином, запалювання являє собою два послідовних процесу – спочатку початкове осередкове запалення, яке викликає первинне полум'я, і потім поширення полум'я від джерела по всьому об'єму горючої суміші.
ОСНОВНІ ПОНЯТТЯ ХІМІЧНОЇ КІНЕТИКИ Наведемо короткі відомості з хімічної кінетики - науки про механізм і швидкості хімічних реакцій. Найважливіша величина – швидкість хімічної реакції – визначається зміною в часі кількості будь-якого з вихідних речовин або продуктів реакції в результаті хімічного перетворення. Хімічні реакції можуть протікати гомогенно (в обсязі однієї фази) або гетерогенно (на поверхні розділу фаз). Швидкість гомогенної реакції - це кількість речовини, що вступає в реакцію або утворюється в результаті реакції в одиницю часу в одиниці об'єму. Для реакцій, що протікають в системах постійного об’єму
де
Якщо i-а речовина – продукт реакції, то Хімічні реакції діляться на прості і складні. Проста реакція протікає в одному напрямку і в один етап; кінетична схема має такий вигляд
де До складних належать оборотні реакції (одночасно протікають у двох протилежних напрямках)
паралельні реакції, що описуються, в окремому випадку кінетичної схемою
і послідовні реакції, наприклад
Для простої реакції можна записати стехіометричне рівняння
де Стехіометричне рівняння дозволяє встановити зв’язок між швидкостями простої реакції з різних компонентів:
При квазістаціонарному протіканні процесу всі вихідні речовини повинні зникати, а продукти - з’являтися в результаті хімічної реакції в еквівалентних кількостях, тобто повинно задовольнятися умова стехіометрії:
Чим більша величина , тим більше по модулю повинна бути швидкість реакції
Величина
де k - константа швидкості реакції, чисельно рівна її швидкості при поодиноких концентраціях. Підкреслимо, що в це рівняння входять тільки концентрації вихідних речовин в ступені їх стехіометричних коефіцієнтів. Сума стехіометричних коефіцієнтів
Стехіометричний порядок простої реакції - завжди ціле число (не дрібне) і не перевищує трьох (ймовірність одночасного зіткнення більш ніж трьох молекул близька до нуля). Застосовувати закон діючих мас для розрахунку складних реакцій можна для одностадійної оборотної реакції, швидкість якої
де За законом діючих масс
де, При величині u = 0, що відповідає хімічному рівноваги системи. У загальному випадку для опису складної реакції потрібно кілька стехіометричних рівнянь. Складаючи їх, отримуємо брутто-рівняння реакції, що описує процес в цілому, але не відображає істинного механізму хімічних перетворень. Для складної реакції можна (на основі експериментів) записати рівняння, що зв'язує швидкість реакції з концентрацією вихідних речовин (кінетичне рівняння)
де для для для де Швидкість переважної більшості реакцій (простих і складних) підвищується з ростом температури Т, а константа швидкості реакції підпорядковується закону Арреніуса
де z - предекспонент (предекспоненціальний множник, частотний фактор), розмірність якого дорівнює розмірності константи швидкості реакції [z] = [k]; Т - абсолютна температура, К; E - енергія активації реакції, Дж×моль-1; R0 = 8.3134 Дж×К-1×моль-1- Універсальна газова стала. Безрозмірний показник експоненти в законі Арреніуса називається критерієм Арреніуса:
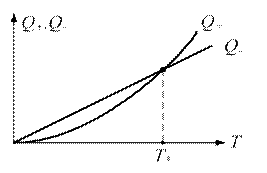
де Цей критерій виражає чутливість швидкості хімічної реакції до зміни температури. Чим вище значення Arn, тим сильніше ця чутливість. Вхідні в закон Арреніуса величини z і E називаються кінетичними константами хімічної реакції. Фізичний сенс енергії активації Е для простої реакції полягає в тому, що це енергія, якою повинна володіти молекула для того, щоб вступити в реакцію. Для складних реакцій Е не має простого фізичного сенсу. Значення z, Е визначаються, як правило, експериментальним шляхом. Кінетичні константи повністю визначають швидкість протікання кожної конкретної реакції, в тому числі і реакції займання або горіння. Завдання експериментального визначення цих констант є найважливішою при дослідженні фізико-хімічних процесів в високоенергетичних установках. Хімічна реакція проходить з виділенням тепла (екзотермічна реакція), або з його поглинанням (ендотермічна реакція). Якщо пряма реакція - екзотермічна, то зворотна - ендотермічна. Кількість тепла, що виділяється при повному реагуванні одиниці кількості речовини (1 моль або 1 кг), називається тепловим ефектом реакції. Розмірність теплового ефекту реакції ТЕПЛОВА ТЕОРІЯ Самозапалювання Температура, до якої необхідно нагріти горючу речовина, щоб вона запалала, називається температурою самозаймання Т. Хімічна реакція може закінчитися самозайманням при наступних умовах. Виділення теплоти в результаті реакції, тобто екзотермічність реакції. Можливість протікання реакції при температурах нижчих, ніж температура самозаймання. Здатність реакції до різкого прискорення при підвищенні температури (за законом Арреніуса). Процес самозаймання речовин відбувається наступним чином. При нагріванні горючої суміші (наприклад, суміші парів бензину з повітрям) можна досягти такої температури, при якій в суміші починає протікати повільна реакція - окислення. Ця реакція супроводжується виділенням теплоти, і суміш починає нагріватися вище тієї температури, до якої її нагріли. Одночасно з тепловиділенням і нагріванням суміші відбувається тепловіддача від суміші в навколишнє середовище за рахунок теплопровідності, конвекції і випромінювання. Якщо швидкість реакції окислення невелика, то тепловіддача перевищує виділення теплоти. При цьому, після деякого підвищення температури, швидкість реакції починає знижуватися і самозаймання не відбувається. Якщо суміш нагріти ззовні до більш високої температури, то разом зі збільшенням швидкості реакції збільшується і кількість теплоти, що виділяється в одиницю часу. При досягненні певної температури Т, яка залежить від зовнішніх умов, швидкість тепловиділення починає перевищувати швидкість тепловіддачі, в результаті чого реакція інтенсивно прискорюється. У цей момент відбувається самозаймання речовини. Таким чином, температура самозаймання реагуючої речовини - це таке значення температури, при якому швидкість тепловиділення Q + (Дж /с) стає рівною швидкості тепловідводу Q-(Дж / с): Q+(Т) = Q- (Т). Залежності Q + (Т) і Q-(Т), побудовані на одному графіку, називаються діаграмою Семенова (рис. 2.1). Точка перетину кривих теплонадходження і тепловідведення визначає величину температури самозаймання Т (рис. 2.1). Кількісна теорія теплового самозаймання була розвинена академіком М.М.Семеновим в 1928р. на основі механізму ланцюгових реакцій. Згідно з цим механізмом, збільшення температури суміші веде до збільшення довжини ланцюга і числа, утвореного внаслідок теплового руху активних молекул. При деякому значенні температури Т довжина ланцюга стає такою, що число розгалужень в ній стає більше числа обривів. Реакція при цьому набуває прискорення і відбувається самозаймання суміші. З цього випливає, що умовою ланцюгового самозаймання є рівність числа розгалужень числу обривів.
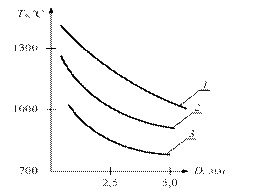
Рис. 2.1. Діаграма Семенова Температура самозаймання однієї і тієї ж речовини залежить від зовнішніх умов і може змінюватися в широких межах. Величина Т характеризує ступінь пожежонебезпеки речовини - чим нижче температура самозаймання Т, тим більша пожежонебезпека. Для визначення температури самозаймання використовуються два методи - нагрівання горючої суміші в посудині заданого обсягу і займання суміші нагрітою кулькою або ниткою. В останньому випадку виміряна величина Т буде залежати як від розміру кульки, так і від його матеріалу. Чим менше діаметр кульки, тим вище повинна бути його температура, що забезпечує самозаймання газової суміші. Великий вплив на величину Т надає каталітична дія матеріалу кульки або нитки. Графік залежності Т * від діаметра платинової кульки D для деяких горючих газів наведено на рис. 2.2
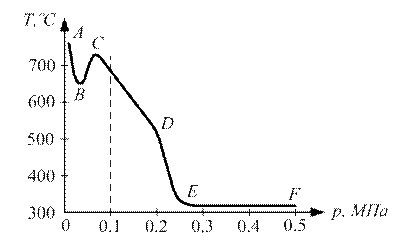
Рис. 2.2. Залежність температури самозаймання газів від діаметра нагрітого кульки: 1 - пентан, 2 - світильний газ, 3 – водень ГРАНИЦЯ САМОЗАЙМАННЯ Величина температури самозаймання Т сильно залежить від тиску реагуючих газів. На рис.2.3 наведені межі області самозаймання типових вуглеводнів (суміші горючих газів і парів з повітрям) залежно від тиску середовища. Для сумішей, параметри яких - тиск р і температура Т – лежать вище кривої ABCDEF, відбудеться самозаймання. Якщо параметри суміші р, Т лежать нижче кривої ABCDEF, то самозаймання не відбувається. Розглянемо зміну температури самозаймання Т вуглеводневих сумішей при підвищенні та зниженні тиску. При підвищення тиску суміші вище атмосферного (р> 0.1 МПа) величина Т різко знижується, особливо при р> 0,2 МПа (ділянка DЕ). При р>0,3МПа величина температури самозаймання стає постійною, тобто Т = const (ділянка ЕF). При тисках нижче атмосферного величина температури самозаймання Т спочатку різко підвищується, досягаючи максимуму (точка С), а потім знижується, утворюючи впадину АВС.
Рис. 2.3. Область самозаймання вуглеводнів в залежності від тиску суміші Крім параметрів навколишнього середовища, тобто тиску і температури, величина Т залежить від складу горючої суміші. На рис. 2.4 приведена залежність температури самозаймання Т від процентного вмісту метану (СН4) в повітрі. Як видно з графіка, найбільш низьке значення Т відповідає суміші, що містить 6% метану в повітрі, а найбільш високе значення Т - суміші, що містить 14% метану (верхня межа вибуху). Зазначимо, що залежність Т від складу суміші завжди має мінімум, наведений на рис.2.4. При цьому найменшою температурою самозаймання із сумішей горючих парів і газів з повітрям має суміш, близька до стехіометричної.
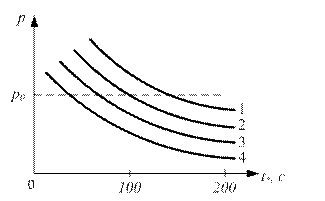
Рис. 2.4. Залежність Т від вмісту метану в повітрі ПЕРІОД ІНДУКЦІЇ Досліджувана речовина, яку розмістили в ємності, що нагрівається, запалюється не відразу, а через деякий проміжок часу. Час з моменту введення горючої речовини в нагріту посудину до її самозаймання називається періодом індукції t . Величина періоду індукції t * залежить від складу горючої суміші, а також змінюється в залежності від кількості речовини, тиску, температури посудини, її розмірів і інших чинників. На рис. 2.5 приведена залежність t від тиску для суміші диметилового ефіру (СН3ОСН3) з киснем при температурі в посудині Т = 2450С . Як видно з графіка, зі зростанням тиску період індукції різко зменшується. На рис. 2.6 приведена залежність періоду індукції t суміші метану (СН4) з киснем від тиску для різних значень температури посудини. Як видно з наведеного графіка, період індукції також різко зменшується зі збільшенням тиску. Для однакових значень тиску суміші, наприклад, для р = р0 (рис. 2.6), величина періоду індукції t тим більше, чим нижче температура судини. Крім термодинамічних параметрів середовища - температури і тиску, величина t залежить і від складу газової суміші. У табл. 2.1 наведено дані по t для метано-повітряної суміші з різним вмістом метану. Як випливає з наведених даних, зі збільшенням вмісту горючого газу в суміші, період індукції зростає. Період індукції відіграє важливу роль не тільки для сумішей горючих газів з повітрям, а й для пилоповітряних сумішей і твердих палив. Цей параметр має практичне значення при оцінці пожежної безпеки деяких виробництв. Відзначимо, зокрема, лакофарбові цехи, великі гаражі, шахти, рудники, елеватори, в яких знаходяться, випаровуються легкозаймисті рідини (лак, бензин) або аерозолі.
Рис. 2.5. Вплив тиску на величину періоду індукції
Рис. 2.6. Вплив температури на величину періоду індукції Таблиця 2.1 Значення періоду індукції (t, с) в залежності
Поиск по сайту: |
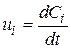
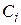 – концентрація i-го речовини,
– концентрація i-го речовини, 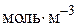 або
або 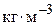 ;
;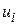 – швидкість реакції по i-му речовині,
– швидкість реакції по i-му речовині, 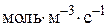 або
або 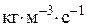
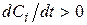 , вихідна речовина, то
, вихідна речовина, то 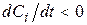 .
.
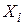 – вихідні речовини;
– вихідні речовини; 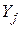 – продукти реакції.
– продукти реакції.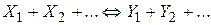
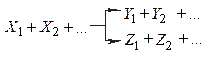

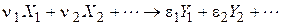
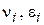 - стехіометричні коефіцієнти, відповідно рівні числам молекул вихідних речовин і продуктів реакції, що беруть участь в елементарному процесі.
- стехіометричні коефіцієнти, відповідно рівні числам молекул вихідних речовин і продуктів реакції, що беруть участь в елементарному процесі.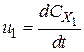 ;
; 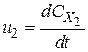 ;
; 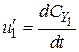 ;
; 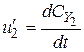
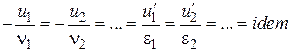
 або
або 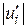 (тобто при більшому значенні стехіометричного коефіцієнта більша кількість відповідної речовини реагує в одиницю часу). Звідси випливає, що незалежно від вибору речовини, швидкість реакції можна охарактеризувати величиною
(тобто при більшому значенні стехіометричного коефіцієнта більша кількість відповідної речовини реагує в одиницю часу). Звідси випливає, що незалежно від вибору речовини, швидкість реакції можна охарактеризувати величиною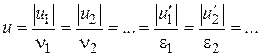
 називається швидкістю простої реакції без відношення до будь-якого конкретного компоненту. Швидкість простої реакції підкоряється закону діючих мас
називається швидкістю простої реакції без відношення до будь-якого конкретного компоненту. Швидкість простої реакції підкоряється закону діючих мас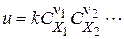
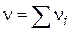 , що дорівнює кількості молекул, що беруть участь в одиничному акті, називається стехіометричним порядком (молекулярна) реакції:
, що дорівнює кількості молекул, що беруть участь в одиничному акті, називається стехіометричним порядком (молекулярна) реакції: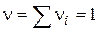 - Мономолекулярна реакція;
- Мономолекулярна реакція;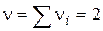 - Бімолекулярний реакція;
- Бімолекулярний реакція;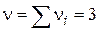 - Трімолекулярная реакція.
- Трімолекулярная реакція.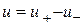
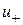 ,
,  - Швидкості реакції в прямому і зворотному напрямках.
- Швидкості реакції в прямому і зворотному напрямках.
 ,
, 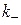 - константи швидкості прямої і зворотної реакцій.
- константи швидкості прямої і зворотної реакцій.
 - порядок реакції по i -му речовині;
- порядок реакції по i -му речовині; 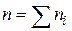 - порядок реакції (кінетичний порядок реакції).На відміну від
- порядок реакції (кінетичний порядок реакції).На відміну від 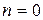 ,
, 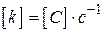 ;
;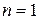 ,
, 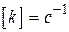 ;
; ,
,  ,
,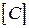 - прийнята розмірність концентрації. Різниця в розмірності константи швидкості реакції
- прийнята розмірність концентрації. Різниця в розмірності константи швидкості реакції 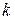 пов'язано з тим, що розмірність швидкості реакції завжди повинна бути
пов'язано з тим, що розмірність швидкості реакції завжди повинна бути 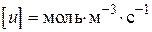 або.
або. 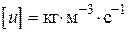 .
.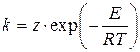

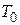 - характерна температура.
- характерна температура. або
або  .
.