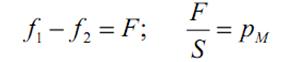|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Роль поверхностного натяжения в образовании мономолекулярного слояСтр 1 из 5Следующая ⇒
Кафедра «Микро- и нанотехники»
Утверждаю Зав. кафедрой МНТ
___________Ю.М. Плескачевский
Лабораторная работа № 6 По дисциплине «Материалы микро- и наносистемной техники» «Получение мономолекулярных слоев на кремнии с использованием технологии Ленгмюра-Блоджетт»
Составитель доцент Кузнецова Т. А.
Минск 2013 Цель работы: Получить практические навыки нанесения моно- и мультимолекулярных органических пленок методом Ленгмюра–Блоджетт на твердые поверхности и определения их толщины методом атомно-силовой микроскопии.
Теоретическая часть Амфифильные молекулы Ленгмюровские пленки - мономолекулярные пленки нерастворимых амфифильных веществ на поверхности жидкости. Одни органические молекулы гидрофильны, а другие гидрофобны. Однако, существуют сложные молекулы, разные части которых обладают в этом отношении разными свойствами, а молекула в целом называется амфифильной Например, в молекуле стеариновой кислоты, имеется полярная головка, образованная группой — СООН, которая может отдать свой протон воде, а сама зарядиться отрицательно. Головка, таким образом, будет удерживаться в воде силой кулоновского притяжения. В то же время гидрофобный углеводородный хвост — С17Н35 выталкивается из воды. Для такой молекулы характерно расположение на границе раздела жидкой и газовой фазы. К амфифильным веществам относятся мыла (соли жирных кислот), фосфолипиды, из которых строятся биологические мембраны.
Рисунок 1 – Расположение молекулы стеариновой кислоты на поверхности воды
Межмолекулярное взаимодействие внутри жидкости и на поверхности раздела фаз
Молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы f1, чем со стороны газообразной f2 (f1 >> f2). Результирующая сила Р, пропорциональной разности сил (f1 - f2), направлена внутрь жидкости. Эта сила, отнесенная к единице поверхности (1 м2), называется внутренним (молекулярным) давлением pM.
Рисунок 2 - Межмолекулярное взаимодействие внутри жидкости и на поверхности раздела фаз
Молекулярное давление определяется силой сцепления молекул, оно тем выше, чем полярнее вещество.
Роль поверхностного натяжения в образовании мономолекулярного слоя Увеличение поверхности сопровождается увеличением поверхностной энергии системы – энергии Гиббса. Бесконечно малое изменение поверхностной энергии Гиббса dG с бесконечно малым изменением поверхности dS при постоянстве давления p и температуры T дается выражением: dG=σdS, где σ - поверхностное натяжение. Таким образом, поверхностное натяжение σ=(G/dS)| T,p,n = const, где n – число молей компонентов. Энергетическое определение: поверхностное натяжение – есть удельная свободная поверхностная энергия Гиббса. Тогда поверхностное натяжение равно работе затраченной на образование единицы поверхности (Дж/м2). Силовое определение: поверхностное натяжение – это сила, на поверхности по касательной к ней и стремящаяся сократить поверхность тела до минимально возможной при данном объеме и условиях (Н/м). [Дж/м2 = Нм/м2 = Н/м] Согласно второму закону термодинамики, энергия Гиббса системы самопроизвольно стремиться к минимальному значению. С увеличением температуры значение поверхностного натяжения границы раздела “газ-жидкость” уменьшается
Поиск по сайту: |