 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакции на пиримидиновый цикл: (не ГФ) ⇐ ПредыдущаяСтр 2 из 2
а) При взаимодействии с конц серной кислотой и раствором калия дихромата появляется стойкое зеленое окрашивание. б) При нагревании с реактивом Манделина (ванадат аммония в конц серной кислоте) появляется травянисто-зеленое окрашивание переходящее в голубое. в) при сплавлении с резорцином и конц серной кислотой и последующим подщелачивании NaOН появляется зеленая флюоресценция. г) мурексидная проба: при нагревании с пергидролем и НС1 в присутствии аммония хлорида и последующим прибавлением раствора аммиака появляется пурпуровое окрашивание. Реакции отличия барбитуратов друг от друга: (не ГФ) Реакция конденсации с формальдегидом получаются различно окрашенные соединения. Специфические реакции: на функциональные группы 1) С реактивом Марки (фенобарбитал, бензонал, гексенал) – характерное окрашивание. 2) Реакция с FeCl3 на бензонал (бензойная кислота) – основная соль железа бензоата розовый осадок. 3) обесцвечивание перманганата калия или бромной воды – на гексенал. 4) Сера в тиопентале натрия с Pb(CH3COO)2 → PbSO4 ↓ темный + кНС1 → Н2S↑.
Количественное определение: 1. Барбитураты-кислоты определяют методом нейтрализации в среде ДМФА. Алкалиметрия (ГФ) в неводных средах титрант – 0,1М раствор NaOН в смеси метилового спирта с бензолом, индикатор тимоловый синий в ДМФА до синего окрашивания 2. Для натриевых производных – Ацидиметрия, основан на вытеснении сложной органической кислоты из ее соли. Инд м\о
O O 3. Аргентометрия безиндикаторный метод титруют нитратом серебра до помутнения Э=Мм или с индикатором хроматом калия Э=Мм\2 4. Броматометрия прямое титрование для гексенала: KBrO3 + 5KBr + H2SO4 = 3Br2 + 3KSO4 + 3H2O
CH3 O Титруют броматом калия в присутствии бромида калия инд м\о или м\к от розовой окраски до обесцвечивания. В точке эквивалентности избыточная капля бромата выделяет бром, который окисляет индикатор и раствор обесцвечивается. Э=Мм\2
Производные пиримидинтиазола Основание: пиримидин + тиазол
N S Пиримидин Тиазол Тиамина хлорид Thiamini chloridum
Тиамина бромид Thiamini bromidum
Тиамин содержится в дрожжах, в зародышах и оболочках семян злаковых, в орехах, арахисе. Эти продукты могут служить источником получения, процесс извлечения сложен, а выход мал, поэтому их получают синтетически. В организме тиамин фосфорилируется в кокарбоксилазу. Химические свойства: 1. Основный характер за счет азота в тиазольном кольце. 2. Взаимодействуют с осадительными реактивами. 3. Устойчивы в кислой среде. В щелочной среде происходит расщепление тиазолевого центра с образованием тиаминтриола. 5. Термолабильны (при 120°, в течении 15 минут полностью разрушаются). Описание: белые с желтоватым оттенком порошки со специфическим запахом. Гидрохлорид – гигроскопичен. Растворимость: ЛР в воде, метаноле, ТР в этаноле, ПНР в органике. Водные растворы имеют кислую реакцию Подлинность: 1. Реакции на Cl-, Br-. Реакция образования свободного брома под действием хлорамина (желто-бурое окрашивание хлороформного слоя) ГФ отличие хлорида от бромида. 2. Тиохромовая проба (ГФ) Специфической реакцией на тиамин является тиохромовая проба – реакция, основанная на окислении тиамина в щелочной среде K3[Fe(CN)6]. Тиохром извлекают изоамиловым спиртом. Полученные спиртовые растворы в УФ свете дают синюю флюоресценцию, которая исчезает при подкислении (НС1) и вновь появляется при подщелачивании (NaOН)
H2
H3C N N S 3) Препараты дают осадки с общеалкалоидными осадительными реактивами на алкалоиды (пикриновая кислота). 4) Как и другие третичные амины, тиамин при нагревании с уксусным ангидридом и лимонной кислотой приобретает красное окрашивание. 5) при сплавлении с кристаллами натрия гидроксида тиамин разрушается с образованием сульфидов, которые обнаруживаем с помощью раствора натрия нитропруссида (красно-фиолетовое окрашивание)
Чистота: Количественное определение: а) Алкалиметрия (индикатор – БТС или ф\ф): RN+Br-HBr + NaOH à RNBr + NaBr + H2O б) Аргентометрия: Среда – HNO3. Индикатор: железоаммонийные квасцы. NH4SCN + FeNH4(SO4)2 à Fe(SCN)3 RN•Br + NaBr + 2AgNO3 à RN•NO3 + NaNO3 + 2AgBr↓ В точке эквивалентности – обесцвечивание. AgNO3 + Fe(SCN)3 à AgSCN↓ + Fe(NO3) Фактор равен 1. Концентрация NH4SCN – 0,1М.
3. Аргентометрия по методу Фаянса. Индикатор БФС. Фактор равен ½. Тиамина Хлорид ГФ 1. Неводное титрование с добавлением Hg(CH3COO)2. RNCl•HCl + 2HClO4 + Hg(CH3COO)2 à RN•ClO4- + HgCl2 + 2CH3COOH Фактор равен ½. Хранение: хорошо укупоренная тара без доступа света, при контакте с металлами восстанавливается и инактивируется. Применение: при нарушении функций нервной системы, как витамин, при язвенной болезни желудка и двенадцатиперстной кишки, при заболевании печени, атонии кишечника, экземе, псориазе. Порошок, таблетки, растворы для инъекций.
Поиск по сайту: |

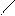
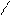
 O O
O O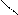



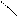

 N —C R NН—C R
N —C R NН—C R
 Na
Na 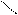


 О—С C НС1 O=C C + NaС1
О—С C НС1 O=C C + NaС1
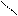

 NН—C R1 NH—C R1
NН—C R1 NH—C R1










 N
N N связаны между собой в молекуле метиленовой группой
N связаны между собой в молекуле метиленовой группой









 CH3
CH3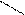




 N N—
N N—
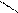




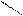
 Br•HBr NaOH
Br•HBr NaOH H3C N NH2 S OH
H3C N NH2 S OH CH3
CH3
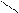







 H3C N N O SH
H3C N N O SH


