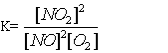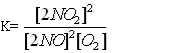|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Хімічна кінетика і термодинаміка
1.Який закон лежить в основі визначення швидкості хімічної реакції? A *діючих мас B Вант-Гоффа C Генрі D Рауля E періодичний закон Менделєєва
2.Закон діючих мас описує залежність швидкості хімічних реакцій від: A *Концентрацій реагуючих речовин B Площі поверхні стикання реагуючих речовин C Природи реагуючих речовин D Температури системи E Наявності каталізаторів
3.Реакція між натрієм и водою є: A *екзотермічною, заміщення B ендотермічною, сполучення C ендотермічною, обміну D ендотермічною, заміщення E ендотермічною, оборотньою
4.Принцип Ле-Шательє дає можливість контролю протікання хімічної реакції як в лабораторії, так і в промисловості. Вкажіть, який з наведених процесів повинен проводитися при підвищеному тиску: A *3H2(г)+N2(г)=2NH3(г) B Fe(т)+H2O(пара)=FeO(т)+H2(г) C N2(г)+O2(г)=2NO(г) D C(т)+О2(г)=CO2(г) E H2(г)+Cl2(г)=2HCl(г)
5.При розчиненні солі в воді температура розчину зменшилась. Значить це процес: A *ендотермічний B екзотермічний C ізобаричний D адіабатичний E ізохоричний
6.В яких одиницях вимірюється швидкість хімічної реакції в гомогенних системах? A *Моль•л-1•с-1 B Моль•мл-1•с-1 C Моль•м3•с-1 D Моль•л-1•хв-1 E Моль•м2•хв-1
7.До зростання швидкості реакції внаслідок збільшення енергії молекул приводить: A *Нагрівання B Освітлення C Опромінення D Охолодження E Всі названі способи
8.На скільки градусів потрібно підвищити температуру, щоб швидкість зросла у 64 рази, якщо γ=2,0? A *На 60°С B На 40°С C На 50°С D На 70°С E На 80°С
9.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 8 раз? A *2 B 5 C 20 D 50 E 100
10.Як зміниться швидкість реакції 2CО+О2= СО2 між карбону (II) оксидом і киснем, якщо концентрацію вихідних речовин збільшити в 5 разів? A *Зросте в 125 раз B Зросте в 5 раз C Зросте в 25 раз D Зросте в 175 раз E Зросте в 625 раз
11.Який із наведених записів, згідно закону діючих мас, виражає швидкість процесу 2SO2(г) + O2(г) = 2SO3(г): A *k[SO2]2•[O2]. B k[2SO2]•[O2]. C k[SO2]•[O2]. D k[SO2]2 + [O2]. E [SO2]2 + [O2].
12.Одним із законів хімічної кінетики є закон, який формулюється так: "швидкість хімічної реакції пропорційна добутку молярних концентрацій реагуючих речовин". Це закон: A *діючих мас B сталості складу C еквівалентів D розведення Оствальда E збереження маси речовин
13.Під нормальними умовами (н.у.) в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=273К B р=101,3 атм; Т=298К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС
14.Під стандартними в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=298К B р=101,3 атм; Т=273К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС
15.Експериментально теплоти згоряння (а також ентальпії утворення) визначають приладом: A *Калориметром B Спектрофотометром C Апаратом Кіппа D Колориметром E Кондуктометром
16.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 50ºС швидкість хімічної реакції зростає у 32 рази? A *2 B 4 C 5 D 6 E 3
17.Каталізатори, які сповільнюють швидкість хімічної реакції при підвищенні температури, називають: A *Інгібітори B Інсульти C Інкубатори D Інтерферометри E Інградієнти
18.Речовини білкової природи, які виробляються клітинами живих організмів і значно збільшують швидкість біохімічних реакцій, це - … A *Ферменти (ензими) B Феромагнетики C Ферити D Фулерени E Ферати
19.Яке співвідношення представляє собою константу рівноваги для хімічної рівноваги, що описується рівнянням реакції: 2NO(г) + О2(г) = 2NO2(г)? A* B C D E 20.Зміщенню рівноваги в системі 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г); ∆Н<0 в сторону утворення продуктів реакції сприяє все, окрім : A *Підвищення температури B Підвищення концентрації H2S C Пониження концентрації SO2 D Підвищення тиску E Пониження температури
21.Швидкість реакції Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(пара) при V=const і збільшенні кількості H2 в 2 рази зросте у: A *8 разів B 2 рази C 4 рази D 16 разів E 6 разів
22.Швидкість яких реакцій підвищується із зростанням температури? A *ендотермічних B екзотермічних C будь-яких D окисно-відновних E каталітичних
23.Гомогенними називають реакції: A *які відбуваються в однорідному середовищі B які відбуваються в неоднорідному середовищі C які відбуваються з виділенням тепла D які відбуваються з поглинанням тепла E жодної правильної відповіді
24.В якому напрямі зміститься рівновага реакції 2NOCl=2NO+Cl2 при підвищенні тиску? A *вліво B не зміниться C вправо D зміниться E жодної правильної відповіді
25.Як зміниться швидкість прямої хімічної реакції N2 +3H2 = 2NH3, якщо об’єм газової суміші зменшити в 3 рази? A *збільшиться у 81 раз B збільшиться у 27 раз C збільшиться у 9 раз D збільшиться у 3 рази E зменшиться у 27 раз
26.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 60ºС швидкість хімічної реакції зростає у 1500 раз? A *3,4 B 2,7 C 3,8 D 1,4 E 2,4
27.У скільки разів швидкість прямої реакції 3О2 = 2О3 більша від швидкості зворотної при збільшенні тиску в 3 рази? A *у 3 рази B у 27 раз C у 9 раз D у 81 раз E у 6 раз
28.В якому напрямі зміститься рівновага реакції N2+O2=2NO при підвищенні тиску? A *не зміниться B вліво C вправо D зміниться E жодної правильної відповіді
29.В яких межах змінюється температурний коефіцієнт швидкості для більшості реакцій? A *2-4 B 2-3 C 3-4 D 4-5 E 5-6
30.Яке рівняння є математичним виразом закону діючих мас для реакції 2NO(г) + Cl2(г) = 2NOCl(г): A *k[NO]2•[Cl2] B k[NO]•[Cl2] C k[NOCl2] D k[NO]2•[Cl]2 E k2[NO]•[Cl2].
31.Яке рівняння є математичним виразом закону діючих мас для реакції 2Al(т) + 3Cl2(г) = 2AlCl3(т): A *k[Cl2]3 B k[Al]2•[Cl2]3 C k[Al]•[Cl2] D k[Al]2•[Cl]3 E жодної правильної відповіді
32.Як зміниться швидкість хімічної реакції між оксидом карбону (II) та киснем, якщо концентрацію вихідних речовин збільшити в 5 раз? A *збільшиться у 125 раз B збільшиться у 25 раз C збільшиться у 5 раз D збільшиться у 35 рази E не зміниться
33.У скільки разів слід збільшити концентрацію водню в системі N2 + 3H2 = 2NH3, щоб швидкість прямої реакції збільшити в 125 раз? A *у 5 раз B у 15 раз C у 25 раз D у 3 рази E у 27 раз
34.Чому дорівнює константа рівноваги реакції І2 + H2 = 2НІ, якщо константа швидкості прямої реакції дорівнює 0,16, а зворотної – 0,05? A *3,2 B 2,3 C 0,3 D 1,8 E 2,7
35.Які з перерахованих взаємодій приведуть до зміни константи швидкості реакції? A *зміна температури B зміна тиску C зміна реакційного об’єму D введення в систему каталізаторів E освітлення
36.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 1000 раз? A *10 B 5 C 20 D 50 E 100
37.Обчисліть константу рівноваги реакції 2NO+O2=2NO2, якщо рівноважні концентрації дорівнюють: [NO2]=0,8 моль/дм3, [O2]=0,2 моль/дм3, [NO]=0,4 моль/дм3. A *20 B 16 C 18 D 22 E 24
38.Що вивчає хімічна термодинаміка? A *перетворення різних форм енергії при фізичних та хімічних процесах B перетворення різних форм енергії хімічних реакціях C теплові ефекти реакцій D перетворення лише певного виду енергії E жодної правильної відповіді
39.Для якої речовини ентальпія утворення не дорівнює нулю? A *С(алмаз) B С(графіт) C I2 D Cl2 E жодної правильної відповіді
40.Вкажіть речовину, для якої теплота утворення в стандартних умовах дорівнює нулю? A *O2 B H2O C CO2 D C6H12O6 E жодної правильної відповіді
41.Вкажіть речовину, для якої теплота утворення в стандартних умовах дорівнює нулю? A *N2 B H2O C CO2 D HF E жодної правильної відповіді
42.Хімічні процеси супроводжуються тепловими ефектами, що підпорядковуються такому закону: »Тепловий ефект реакції залежить від природи вихідних речовин та продуктів реакції і не залежить від шляху, по якому протікає процес». Це: A *Закон Гесса B Закон Генрі C Закон діючих мас D Закон Нернста E Закон Вант-Гоффа
43.Термодинамічні розрахунки дають змогу визначати можливість і напрям самовільних процесів. В ізольованій системі з цією метою використовують зміну термодинамічної функції: A *Енергії Гіббса BЕнергії Гельмгольца CВнутрішньої енергії DЕнтропії EЕнтальпії
44.Температурний коефіцієнт реакції дорівнює 3. У скільки разів зміниться швидкість реакції внаслідок зміни температури на 30°С? A *У 27 разів BУ 18 разів CУ 9 разів DУ 36 разів EУ 45 разів
45.Хімічна рівновага у системі FeO(т.)+H2(г.)=Fe(т.)+H2O(г); ∆H>0 зміститься в бік утворення продуктів реакції за: A *підвищення температури B підвищення тиску C використання каталізатора D зниження тиску E підвищення концентрації H2
Поиск по сайту: |