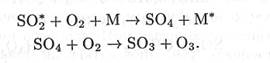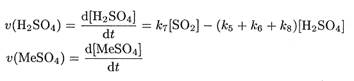|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Трансформация соединений серы в тропосфере ⇐ ПредыдущаяСтр 2 из 2
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений неорганических соединений серы в атмосферу. Около 95% из этого количества составляет диоксид серы. Из природных источников поступления неорганических соединений серы следует выделить волновую деятельность в океанах, приводящую к образованию аэрозолей. Общее количество серы, содержащейся в аэрозолях в виде сульфатов магния и кальция, оценивается в 44 млн. т в год, что составляет примерно 30% от ее поступления в атмосферу в виде неорганических соединений. Биологические источники неорганических соединений серы выделяют преимущественно сероводород, с которым в атмосферу поступает по различным оценкам от 23 до 49% всех неорганических соединений серы. Масштабы поступления сероводорода в атмосферу и процессы его трансформации в атмосфере изучены еще недостаточно подробно. Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так, над океанами концентрация H2S колеблется от 0,0076 до 0,076 мкг • м -3, а над континентами — от 0,05 до 0,1 мкг • м -3. Принимая во внимание скорость поступления сероводорода в атмосферу и его содержание в тропосфере, можно оценить время его жизни в атмосфере в несколько часов. Как уже отмечалось выше, в тропосфере происходят процессы окисления соединений серы, основным окислителем в которых выступают свободные радикалы. Сероводород, например, последовательно, в ряде стадий окисляется до SО2, детальный механизм этого процесса еще не установлен. Наиболее вероятным представляется протекание следующих реакций:
Полученный в результате диоксид серы, как и SO2, поступающий из других источников, окисляется далее. Механизм этого процесса изучен более подробно. Окисление диоксида серы может протекать в газовой фазе — первый путь, в твердой фазе (окислению предшествует адсорбция) — второй путь и в жидкой фазе (окислению предшествует абсорбция) — третий путь. Газофазное окисление (первый путь) исторически является первой попыткой объяснить процессы окисления диоксида серы в атмосфере. Долгие годы основной механизм процесса связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SO3:
Образующийся SO3 вступает во взаимодействие с молекулой воды:
Однако, как показали исследования последних десятилетий, рассмотренный механизм является возможным, но никак не основным процессом окисления SO2 в газовой фазе. Лабораторные эксперименты показали, что скорость изменения концентрации SO2 в фотохимических камерах, содержащих очищенный воздух, описывается кинетическим уравнением первого порядка. Значение константы скорости процесса составляет 10~3 ч"1. Квантовый выход реакции изменяется от 10~3 до 5 • 10~3. Процесс окисления SO2 в фотохимических камерах значительно ускоряется, если в воздухе содержатся оксиды азота или углеводороды. В этом случае становится возможным протекание процессов с участием атомарного кислорода и свободных радикалов. Атомарный кислород окисляет молекулу S02 при участии третьего тела: Принимая во внимание экспериментально найденное значение константы скорости этого процесса и концентрации атомарного кислорода и третьего тела в атмосфере, можно утверждать, что этот процесс следует учитывать только на высоте более 10 км при концентрации SO2, равной 1мкг • м~3. Время пребывания диоксида серы на высоте 10 км при отсутствии других процессов должно составлять примерно 1000 ч и должно уменьшаться на высоте 30 км до 5-10 ч. Из того, что время жизни диоксида серы в приземном слое воздуха значительно отличается от расчетных значений — по реакции (1.102), следует, что реакция окисления S02 атомарным кислородом не играет существенной роли в трансформации соединений серы в тропосфере; ведущую роль играют свободные радикалы. Протекающие при этом процессы можно представить следующими уравнениями реакций:
Скорость трансформации диоксида серы в воздухе, имеющем средние для тропосферы значения концентраций свободных радикалов, составляет примерно 0,1% • ч"1, что соответствует времени пребывания SO2 в тропосфере, равному 5 суткам. Процесс трансформации диоксида серы резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. Скорость в этом случае может возрасти до 1% • ч"1. Триоксид серы — серный ангидрид — легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты [см. уравнение (1.101)], которые, реагируя с аммиаком или ионами металлов, присутствующими в частицах атмосферной влаги, частично переходят в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, присутствующих в воздухе. В этом случае стадии окисления предшествует адсорбция, часто сопровождающаяся химической реакцией (второй путь окисления диоксида серы):
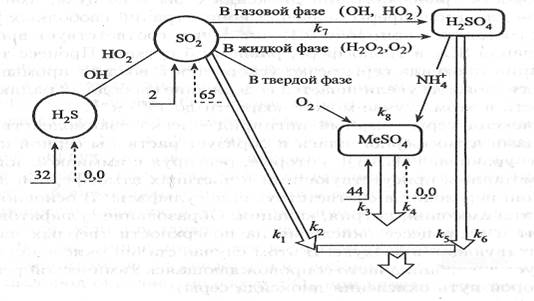
Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в воздухе, резко ускоряют процесс окисления диоксида серы. Как показали лабораторные эксперименты, в присутствии, например, частиц Fe2O3 скорость процесса трансформации SO2 составляет примерно 100% • ч"1. Необходимо отметить, однако, что данное значение получено для воздуха, в котором содержание оксидов железа в 100-200 раз превышало фоновые концентрации. Поэтому данный процесс трансформации диоксида серы играет основную роль лишь в сильно запыленном воздухе, содержащем значительные количества оксидов металлов. Третий путь окисления диоксида серы в тропосфере связан с предварительной абсорбцией SO2 каплями атмосферной влаги. В дождливую погоду и при высокой влажности атмосферы этот путь окисления может стать основным в процессе трансформации диоксида серы. В качестве окислителя в природных условиях часто выступает пероксид водорода. При высоких значениях рН, когда в растворе в основном находятся ионы SO3-, скорость окисления заметно возрастает. Конечным продуктом окисления, как и в случае окисления в газовой фазе, является серная кислота, которая в дальнейшем может перейти в сульфаты. Помимо процессов химической трансформации диоксида серы в серную кислоту и сульфаты сток (вывод из атмосферы) этих соединений происходит в результате процессов мокрого (с атмосферными осадками) и сухого (при контакте с поверхностью почвы, водоема или с растительностью) осаждения. Представленная на рис. 1.4 схема наглядно иллюстрирует тропосферную часть цикла неорганических соединений серы.
Рис. 1.4. Трансформация неорганических соединений серы в тропосфере (числа – млн. т элементной серы в год).
Скорость процессов трансформации и стока диоксида серы, серной кислоты и сульфатов принято представлять в виде кинетических уравнений первого порядка. Скорость соответствующих превращений без учета процессов окисления в твердой фазе можно выразить следующими уравнениями:
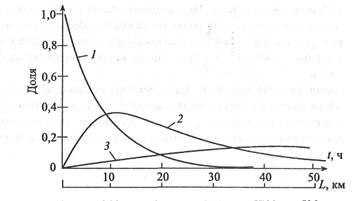
где t — время; [SO2], [H2SO4], [MeS04] — концентрации диоксида серы, серной кислоты и сульфатов соответственно; k1 , k2 , k3 и k4, k5 и k6 — константы скорости процессов мокрого и сухого осаждения диоксида серы, сульфатов и серной кислоты соответственно (см. рис. 1.4); k7 константа скорости процесса трансформации диоксида серы в серную кислоту (учитывает общую скорость окисления в газовой и жидкой фазах) ; k8 — константа скорости образования сульфатов из SO2 и H2S04. Решения системы уравнений (1.109)-(1.111) позволяет определить долю отдельных компонентов, присутствующих в тропосфере в заданное время после выброса единичного объема диоксида серы в атмосферу. Графическое решение системы уравнений, полученное специалистами Института прикладной геофизики РАН А.В.Лысаком, И.М.Назаровым и А.Г.Рябошапко, представлено на рис. 1.5. При решении системы уравнений использовались среднеевропейские
О 300 600 900 1200 1500 Рис. 1.5. Зависимость долей серы, представленной в тропосфере в виде диоксида серы, серной кислоты и сульфатов, от времени пребывания в атмосфере t и удаленности от точечного источника выброса L при скорости ветра 30 км/ч: 1 —диоксид серы; 2 — серная кислота; 3—сульфаты
Поиск по сайту: |