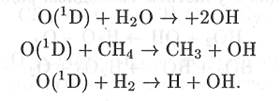|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Свободные радикалы в тропосфереСтр 1 из 2Следующая ⇒
Превращения примесей в тропосфере Тропосфера — нижний, непосредственно соприкасающийся с земной поверхностью слой атмосферы. Именно воздухом тропосферы дышат живые организмы, влага, конденсирующаяся в тропосфере и выпадающая с атмосферными осадками, обеспечивает человека питьевой водой, а проникающее через тропосферу солнечное излучение используется автотрофными организмами в процессе фотосинтеза. После того как в 18-м веке впервые был определен состав атмосферного воздуха, знания о химическом составе тропосферы и происходящих в ней химических превращениях постоянно пополняются. В 19-м и в начале 20-го века в составе тропосферы помимо азота и кислорода были обнаружены инертные газы (аргон, гелий, криптон, неон, ксенон и радон), метан, водород, озон, оксид углерода, диоксид серы, сероводород, а в дождевой воде в этот период были найдены нитрат-, сульфат- и хлорид-ионы и ионы аммония. К середине 20-го века имелась уже достаточно подробная информация о качественном составе атмосферы. С середины 50-х годов интенсивное развитие физико-химических методов анализа и совершенствование приборной базы сделало возможным количественные определения атмосферных примесей, объемы которых не превышали одной миллионной от объема атмосферного воздуха. Как оказалось, несмотря на такие низкие значения концентраций, их роль в химических превращениях, протекающих в окружающей среде, чрезвычайно велика. Одни из них являются токсичными и отрицательно влияют на развитие живых организмов, другие уменьшают прозрачность атмосферы для теплового излучения Земли, третьи оказывают влияние на процессы конденсации паров воды в тропосфере и т. д. Результаты количественного определения микропримесей в тропосфере показали, что их концентрации значительно превосходят равновесные значения, которые были рассчитаны на основании термодинамических данных для примесей, содержащих азот, кислород, углерод (табл. 1.7). Такое различие значений равновесных и истинных концентраций примесей свидетельствует о том, что, несмотря на практически постоянное содержание основных компонентов (N2, 02, Аг), тропосфера является неравновесной, химически активной системой. Поэтому в последние десятилетия основное внимание специалистов в области химии атмосферы направлено на изучение кинетических параметров процессов, вызывающих изменение концентрации примесей в атмосфере. Знания о механизмах и скоростях процессов поступления (эмиссия из природных и антропогенных источников и образование непосредственно в атмосфере) и удаления, или стока (перенос в другие резервуары, сорбция и осаждение на поверхности, трансформация в атмосфере), позволяют составить баланс атмосферной части глобального кругооборота вещества в природе. Свободные радикалы в тропосфере Большинство газообразных примесей, выделяемых с поверхности планеты в атмосферу в результате геологических и биологических процессов, находится в восстановленной форме или в виде оксидов с низкой степенью окисления (сероводород, аммиак, метан, гемиок-сид и оксид азота и т. д.). В то же время анализ атмосферных осадков показывает, что возвращаемые на поверхность планеты примеси представлены в основном соединениями с высокой степенью окисления (серная кислота и сульфаты, азотная кислота и нитраты, диоксид углерода). Таким образом, тропосфера играет на планете роль глобального окислительного резервуара. Таблица 1.7. Концентрация некоторых примесей в атмосфере.
Процессы окисления примесей в тропосфере могут протекать: 1) непосредственно в газовой фазе; 2) в растворе, когда окислению предшествует абсорбция частицами 3) на поверхности твердых частиц, взвешенных в воздухе, когда Окислительная способность атмосферного воздуха не вызывает сомнений и подтверждается термодинамическими расчетами. Однако скорость процессов окисления примесей непосредственно молекулой кислорода в газовой фазе при характерных для тропосферы температурах и давлениях мала. Молекулы кислорода редко являются непосредственной причиной окисления примесей в газовой фазе. Долгие годы протекание процессов окисления в тропосфере связывали с присутствием в ней озона и пероксида водорода. Однако, как показали исследования последних десятилетий, основную роль в процессах окисления, протекающих в газовой фазе, играют свободные радикалы. Имея по одному неспаренному электрону на внешней электронной орбите, свободные радикалы являются сильными окислителями и принимают самое активное участие в процессах окисления примесей в газовой фазе тропосферы. Среди свободных радикалов, обнаруженных в атмосфере, прежде всего следует выделить гидроксидный радикал. Гидроксидный радикал ОН может образовываться при протекании ряда химических превращений. В верхних слоях стратосферы возможна прямая фотодиссоциация воды, в результате которой образуется радикал ОН и атмосферный водород. Этот процесс не является характерным для нижних слоев, поскольку в них практически не проникают необходимые для фотодиссоциации воды жесткие излучения. В тропосфере свободные радикалы образуются, например, при химических превращениях с участием синглетно возбужденного атома кислорода 0(1D), который появляется в атмосфере в результате фотодиссоциации кислорода, озона и оксидов азота:
Образующийся по реакциям (1.35), (1.38), (1.65) и (1.66) синглетно возбужденный атом кислорода может вступать в химические превращения, в результате которых образуется гидроксидный радикал. Наибольшее значение среди таких процессов имеют превращения с участием молекул воды, метана и водорода:
Гидроксидный радикал образуется в тропосфере также при протекании других реакций:
Гидроксидный радикал является активной частицей, принимающей участие в целом ряде химических превращений, протекающих в тропосфере.
Образующийся по реакции (1.66) водород может реагировать с кислородом с образованием гидропероксидного радикала:
В результате реакции гидропероксидного радикала с оксидом азота или озоном в атмосфере вновь может появиться гидроксидный радикал: Н02 + NO -> N02 + ОН (1.79) Н02 + 03 -» 202 + ОН. (1.80) Гидроксидный радикал может также замкнуть цепочку превращений, протекающих с участием свободных радикалов: НО2+ ОН->Н20 + 0 (1.81) НО2+Н02-> Н202 + 02. (1.82) Экспериментальные данные показывают, что концентрация гидроксидного радикала в тропосфере составляет (0,5 -г 5) 10е см~3 и увеличивается в стратосфере до 3 • 107см~3. Содержание гидропероксидного радикала на высоте от 5 до 35 км примерно постоянно и равно 107 — 108см-3.
Поиск по сайту: |