 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Процессы обратимые и необратимые. Принцип локального равновесия
Положению равновесия с молекулярно-кинетической точки зрения отвечает состояние максимального хаоса в изолированной системе. По законам термодинамики такая система вернется в положение равновесия; при удалении от него ее состояние становится все более неустойчивым, и даже малые изменения какого-либо параметра могут перевести систему в новое состояние. Необходимо обобщение теории на необратимые процессы и на открытые системы, которые могут обмениваться с окружающей средой веществом или энергией. Таких обобщений требовала и развивающаяся техника, и многочисленные приложения в физике, химии, биологии. Учет зависимости параметров от времени и положения при нео-днородностях приводил к движению в системах. У. Томсон начал развивать динамическую теорию теплоты (1854), когда французский физик Ж.Пельтье предсказал эффект: при прохождении тока через неравномерно нагретый проводник может наблюдаться поглощение или выделение теплоты в зависимости от направления тока. Эти обратимые явления сопровождаются необратимым процессом — выделением теплоты вдоль неравномерно нагретой цепи и теплопроводностью. Томсон ввел неравенство во второе начало и связал коэффициенты теплоты с температурными коэффициентами электродвижущей силы. Так появилась теория термоэлектричества. Г.Гельмгольц (1878) и В.Нернст (1889) расширили границы применения второго начала термодинамики, а Онсагер обобщил (1931): потоки теплоты и вещества при небольших отклонениях от термодинамического равновесия могут быть выражены как линейные функции градиентов температур и химических потенциалов различных компонентов системы. Принцип линейности Онсагера утверждает: потоки вызываются обобщенными термодинамическими силами (градиенты температуры или концентрации — простейшие примеры термодинамических сил). Термодинамические уравнения движения связывают термодинамические обобщенные силы (градиенты величин) с соответствующими потоками. Законы Фика (для диффузии) и Фурье (для теплопроводности) имеют похожий вид и определяются соответственно градиентами концентрации и теплоты. Этот принцип позволил рассмотреть единым образом все явления переноса. Если в системе имеются флуктуации, то линейный закон приобретает более общее значение. Принцип микроскопической обратимости Онсагер применил к флуктуациям, считая макроскопическим характер их затухания. Он пришел к выводу о равенстве средних скоростей в прямом и обратном направлениях, а потом и к соотношениям взаимности между коэффициентами. На основе его теории в 40—50-е гг. XX в. разрабатывались проблема разделения изотопов методом термодиффузии, вопросы физики плазмы, биологии и др. На выводе уравнений для скорости изменения энтропии развивалось другое направление термодинамики необратимых процессов. Австрийские ученые Яуманн и Лор получили уравнение непрерывности энтропии, обобщив (1911) подход, развитый в 1874 г. Умовым для потока энергии. Уравнение содержало член, отвечающий за скорость возникновения энтропии. Баланс в том, что изменение энтропии в некотором объеме приравнивалось сумме производства энтропий — воспроизведенной и привнесенной в данный объем. Исследование открытых систем возможно на основе только термодинамики необратимых процессов: в них энтропия может возникать и переноситься, тогда как возрастание энтропии пригодно только для изолированных систем. В гигантской фабрике естественных процессов принцип энтропии занимает место директора, который предписывает вид и порядок исполнения всех сделок. Закон сохранения энергии играет роль бухгалтера, который приводит в равновесие дебет и кредит. Для биологических систем, принципиально открытых, такой подход оказался очень плодотворным. Внутренняя релаксация противостоит процессам, нарушающим равновесие. Для разреженных газов — это процессы столкновений. Если возмущающие процессы менее интенсивны, чем релаксационные, то говорят о локальном равновесии, существующем в малом объеме. При этом не обязательно, чтобы в других частях системы состояние было близко к равновесию. Например, газ располагается между неодинаково нагретыми плоскостями. Процесс теплопроводности крайне медленный, газ находится в неравновесном состоянии, а где-то в системе будет малая область с локальным равновесием. Эту идею высказал бельгийский химик И. Пригожин, и она позволила описывать в этой области состояния теми же параметрами, как и при равновесии. Понятие локального равновесия вводят при медленном изменении внешнего воздействия и для времени, большего характерного времени элементарного релаксационного процесса, формирующего равновесие. Эти условия — из статистического рассмотрения процессов. Принцип локального равновесия ограничивает число систем, доступных термодинамическому рассмотрению. Есть также взаимное влияние друг на друга одновременно происходящих необратимых процессов. Существует принцип симметрии Кюри, который в формулировке Вейля гласит: «Если условия, однозначно определяющие какой-либо эффект, обладают некоторой симметрией, то результат их действия не нарушит эту симметрию». Поэтому формально все неравновесные процессы разделяют на скалярные (химические реакции), векторные (теплопроводность, диффузия) и тензорные (вязкое трение). В соответствии с этим принципом величины разных размерностей не могут быть связаны друг с другом. И скалярная величина (химическое сродство) не может вызвать векторный поток (теплопроводность). Сложные системы в отличие от простых, описываемых несколькими параметрами, состоят из большого числа переменных и большого числа связей между ними. В сложной системе появляется из-за внутренних взаимодействий много свойств, которых нет у ее частей (эмерджентные свойства), они — следствие целостности системы. На пути любой достаточно сложной системы к равновесию, которое характеризуется максимумом энтропии, встречаются обстоятельства, не позволяющие это сделать. В качестве таковых выступают граничные условия. Если они постоянны, например, поддерживают Стационарные состояния в открытых системах австрийский (впоследствии канадский) биолог-теоретик Л. Берталанфи назвал текущим равновесием. Он построил теорию биологических организмов на базе обобщений физической химии, кинетики и термодинамики, назвав ее «теорией открытых систем». Берталанфи ввел формальное выражение таких важных свойств системных параметров, как сумма, целостность, организация, рост, конкуренция и т.д., широко применяя аппарат дифференциальных уравнений. Понятие локального, или текущего, равновесия он ввел для живого организма — неравновесной открытой системы. Такие состояния, близкие к равновесным, встречаются в различных областях естествознания. Рассмотрим прерывные явления, моделирующие процессы в различных объектах, — от пленочных биосистем с мембранами до гидродинамических потоков с фильтрацией. Пусть система состоит из двух сосудов, соединенных тонким капилляром, пористой стенкой или проницаемой мембраной, и каждый из сосудов находится в равновесии. Поскольку процессы установления равновесия в каждом из сосудов происходят много быстрее, чем между ними, то к такой системе применимы законы термодинамики необратимых процессов. Если они отличаются температурой Т и давлением р, между ними возникнут потоки массы и энергии, которым соответствуют обобщенные силы разницу температур, будем наблюдать за системой. Сначала возникнут потоки энергии и массы, потом появятся и перекрестные эффекты (массоперенос из-за T и теплоперенос из-за р). Поток массы вызовет противодавление, которое будет препятствовать этому потоку. Через некоторое время установится режим, когда поток массы прекратится вовсе, будет только поток энергии, поддерживаемый Т. Возникнет стационарное состояние, которое неравновесно, так как в системе остаются части с разными силами давления. Это явление названо термомеханическим эффектом и проверено опытным путем. В подобных стационарных состояниях характеристики системы не зависят от времени, поэтому постоянна и энтропия S. Но она все время возникает, поскольку потоки и силы в системе отличны от нуля. Полная энтропия будет постоянна только при поступлении в систему извне отрицательной энтропии или негэнт-ропии, которая компенсирует производство энтропии внутри системы. Производство энтропии минимально в стационарных неравновесных состояниях: скорость приращения энтропии при двух обобщенных силах Х1и Х2, соответствующих потокам I1 и I2, определится суммой ся меняется, и рованной Х1, соответствующей градиенту температуры, исчезает поток I2, связанный с другой силой, т. е. уменьшается сумма или производство энтропии. Теорема о минимуме производства энтропии в стационарном неравновесном состоянии, сформулированная Пригожиным, отражает внутреннюю устойчивость неравновесных систем, ее своеобразную инерционность. Поэтому, если какие-то граничные условия не позволяют системе прийти в устойчивое равновесие, где производством энтропии. Этот вывод годится в случае независимости феноменологических коэффициентов (вязкости, диффузии, теплопроводности) от параметров среды, что справедливо при небольших значениях градиентов и линейных зависимостях между потоками и термодинамическими силами. Устойчивость стационарных состояний с минимальным производством энтропии связана с принципом, сформулированным в 1884 г. Ле Шателье и обобщенным в 1887 г. с точки зрения термодинамики немецким физиком Карлом Брауном. Принцип Ле Шателье—Брауна означает, что система, выведенная внешним воздействием из состояния с минимальным производством энтропии, стимулирует развитие процессов, направленных на ослабление внешнего воздействия. В самом деле, внешнее воздействие меняет фиксированные термодинамические силы (градиент температур, например), система откликнется на это воздействие изменением потока, связанного с этой силой (потока энергии). Вторая нефиксированная сила (например, градиент концентраций) может испытывать флуктуации. Они увеличат производство энтропии по отношению к ее минимуму в стационарном состоянии. В результате система будет эволюционировать в новое стационарное состояние, в котором изменение потока энергии будет меньше первоначального. В 80-е гг. XX в. принцип был обобщен профессором МГУ Е. В. Ступоченко. В стационарных неустойчивых состояниях, когда фиксирована одна из термодинамических сил, вторая может испытывать флуктуации. Производство энтропии возрастет, и система может выйти из стационарного состояния. Однако в силу самопроизвольного стремления в состояние с наименьшим производством энтропии она может вновь перейти в стационарное состояние. Общая теория устойчивости состояний была разработана А.М.Ляпуновым. Эти состояния не теряют своей устойчивости при флуктуациях физических параметров, система за счет внутренних взаимодействий способна погасить возникающие флуктуации. Неустойчивые системы, наоборот, при возникновении флуктуаций способны усиливать их, и в результате такого нарастания амплитуд возмущений система уходит из стационарного состояния. Критерием эволюции при этом является величина торая указывает направление развития физической системы к устойчивому стационарному состоянию. Процессы, о которых здесь шла речь, происходят достаточно медленно, так что на каждом этапе достигается равновесие. Функция диссипации — это прирост энтропии за единицу времени в единице объема в открытых системах, а системы, в которых функция диссипации отлична от нуля, названы диссипативными. В таких системах энергия упорядоченного движения переходит в энергию неупорядоченного движения и, в конечном счете, втеплоту. Практически все системы являются такими, поскольку трение и прочие силы сопротивления приводят к диссипации энер- гии. Принцип локального равновесия и теорема о минимуме производства энтропии в равновесных состояниях были положены в основу термодинамики необратимых процессов. Вопросыдля самопроверки и повторения 1. Вкаких единицах измеряют энергию, работу, мощность? Как эти величины связаны между собой и что характеризуют? Каково значение установления механического эквивалента теплоты? 2. Дайте представление о внутренней энергии. Как измерить внутреннюю энергию? В чем смысл первого начала термодинамики? 3. Поясните модель идеального газа. Как он описывается через макро-и микропараметры? 4. Поясните понятие «энтропия». Как энтропия может быть измерена, как можно изменять ее величину? Поясните принцип Больцмана. 5. Поясните смысл второго начала термодинамики. В чем суть споров о «тепловой смерти Вселенной»? 6. Что такое «начала термодинамики», реальный и идеальный циклы работы тепловых машин? 7. Определите понятие «температура» с точки зрения микроструктуры вещества. Как это определение связано с операционным определением? 8. Поясните понятие изолированной, замкнутой и открытой систем. Насколько распространены равновесные состояния? Что такое «функция состояния»? Приведите примеры. 9. В чем состоит принцип Онсагера и каково его значение? 10. В чем состоит принцип Ле Шателье? Как он связан с принципом Глава 5 КОНЦЕПЦИИ СТРОЕНИЯ
Поиск по сайту: |
 на границах, то переменные состояния стремятся асимптотически к независимым от времени величинам, достигая квазистационарного или стационарного состояния.
на границах, то переменные состояния стремятся асимптотически к независимым от времени величинам, достигая квазистационарного или стационарного состояния.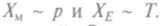 Фиксируя
Фиксируя В общем случае скорость возникновения энтропии
В общем случае скорость возникновения энтропии  определяет-
определяет- При равновесииКогда
При равновесииКогда  нет потоков, то энтропия не
нет потоков, то энтропия не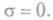 В стационарном неравновесном состоянии при фикси-
В стационарном неравновесном состоянии при фикси- она придет в состояние с минимальным
она придет в состояние с минимальным ко-
ко-