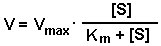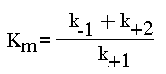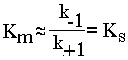|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Учение о скоростях. Любая химическая реакция характеризуется, кроме принципиальной возможности ее протекания (обусловленной законами термодинамики), скоростью процесса. Скорость ферментативной реакции - изменение [S] или [P] в единицу времени. Измерив ее скорость, то есть скорость в присутствии фермента, мы должны измерить скорость реакции и в отсутствии фермента (спонтанно протекающая реакция). Именно эта разность и характеризует работу фермента. ИЗМЕРЯЯ СКОРОСТЬ РЕАКЦИИ, ВСЕГДА НАДО ИЗМЕРЯТЬ НАЧАЛЬНУЮ СКОРОСТЬ ПРОЦЕССА, то есть скорость ферментативной реакции, в достаточно короткий промежуток времени, когда концентрация субстрата меняется, не настолько значительно, чтобы это отразилось на скорости процесса. Единицы измерения скорости реакции могут быть разными. Лучше пользоваться молярными единицами, а время - это минуты или секунды, реже часы. Поэтому скорость реакции может выражаться, например, в мкмоль/мин или ммоль/час. Величина скорости определяется законом действующих масс. В общем случае скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. В случае ферментативной кинетики - одно из реагирующих веществ - фермент, концентрация которого на много порядков МЕНЬШЕ, чем концентрация субстрата. Это определяет некоторые особенности кинетики ферментативного катализа. V = k+2. [E].[S] 1. ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ФЕРМЕНТА ([E]) при постоянной и довольно большой концентрации субстрата ([S]>>[E], [S]=const) имеет такой вид:
Отклонение от линейности графика при очень высокой концентрации фермента возникает из-за нехватки субстрата, поэтому снижается скорость поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо только в том диапазоне концентраций фермента, в котором график линеен. Линейность этого графика позволяет выразить его одной цифрой - тангенс угла наклона к оси абсцисс. Этот тангенс представляет собой величину активности фермента. Именно работа (эффективность) каждого фермента количественно характеризуется величиной его активности, то есть величиной скорости ферментативной реакции в расчете на единицу количества фермента. Единицы активности могут быть различными: мкмоль S/мин.мг или мкмоль S/мин.мл сыворотки крови. МОЛЕКУЛЯРНАЯ АКТИВНОСТЬ - это количество молекул субстрата, которые превращаются одной молекулой фермента за одну минуту при 30оС и прочих оптимальных условиях. Преимущество этой единицы - в том, что можно сравнивать не только активность ферментов из разных источников, но и эффективность разных ферментов. Например, молекулярная активность фермента каталазы составляет 5*106, а карбоангидразы - 36*106. Из линейности графика следует, что по скорости реакции можно судить о количестве фермента. КАТАЛ - это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 секунду. ЮНИТ - это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 Юнит = 16,67 нкатал
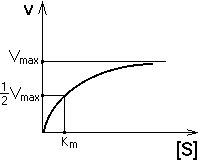
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА ПРИ [E] = const и [S] >> [E]. Чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость гиперболическая.
Предельное значение, к которому стремится гипербола - Vmax данной реакции - характеризует максимальную работоспособность фермента:
Vmax=k+2.[E]
Таким образом, Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата. Км - это КОНСТАНТА МИХАЭЛИСА. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. Эта кривая описывается уравнением Михаэлиса-Ментен:
ФИЗИЧЕСКИЙ СМЫСЛ Км заключается в том, что она представляет собой константу равновесия между двумя реакциями, приводящими к распаду фермент-субстратного комплекса и той реакцией, которая ведет к образованию этого комплекса.
Поскольку значение k+2 всегда намного ниже, чем k-1, то
Ks - субстратная константа. Характеризует константу равновесия 1-го этапа ферментативной реакции. Следовательно, Км обычно тоже довольно близка к Кs. Следовательно, Км, как и Кs, характеризует сродство субстрата к данному ферменту. Но экспериментально определить k-1 и k+2 очень трудно, поэтому трудно определить и Кs. А вот Км можно просто определить, используя координаты Лайнуивера-Бэрка ("Ферменты" стр. 26-27). С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату, а значит тем больше равновесие первого этапа ферментативной реакции сдвинуто вправо - в сторону образования фермент-субстратного комплекса. Значит, будут созданы наилучшие условия для протекания и второго этапа ферментативного процесса. При таких условиях для достижения эффективного превращения субстрата требуется малая концентрация субстрата. Значит, и Vmax теоретически может быть достигнута при малых количествах субстрата. Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно. Км и Vmax - это две кинетические константы, с помощью которых можно характеризовать эффективность работы фермента, в том числе и in vivo.
ИНГИБИТОРЫ ФЕРМЕНТОВ Ингибиторы ферментов - это вещества, замедляющие ферментативные реакции.
Поиск по сайту: |