 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Приклади розв’язання типових задач ⇐ ПредыдущаяСтр 3 из 3
Приклад 1. Розчин, що вміщує 0,85 г цинк хлориду (ZnCl2) в 125 г води, замерзає при Т = 272,77 К. Визначити ступінь дисоціації ZnCl2 у цьому розчині. Розв’язання. Виражаємо насамперед концентрацію розчину у молях на 1000 г води. Оскільки молярна маса ZnCl2 дорівнює 136 г/моль, то
Знаходимо теоретичну величину зниження точки замерзання ΔТз для даного розчину за формулою ΔТз = КзСg.
Для води Кз = 1,86, підставимо це значення у формулу
ΔТз = 1,86∙0,05 = 0,093 К.
Розраховуємо ізотонічний коефіцієнт, маючи на увазі, що за умовою задачі ΔТ′з = 0,23 К;
ί =
Знаходимо ступінь дисоціації
Приклад 2. Обчислити осмотичний тиск 0,5%-ного розчину магній хлориду при T = 291 К, якщо густина розчину дорівнює 1,01 г/мл, ступінь дисоціації 75 %, R = 8,31 Дж/моль∙К. Розв’язання. Осмотичний тиск розчину електроліту розраховуємо за рівнянням: Росм = ίСмRТ.
Знайдемо всі величини, що входять до цієї формули. Ізотонічний коефіцієнт обчислимо за виразом:
ί = 1 + (k – 1) a,
де k – кількість іонів, що утворюється в результаті дисоціації однієї молекули електроліту. Магній хлорид при розчиненні дисоціює на три іони:
MgC12
Отже, k = 3. Тепер підставимо числові значення
ί = 1 + (3 – 1) 0,75 = 2,5.
Молярну концентрацію См обчислимо за формулою перерахунку з процентної концентрації: См = де Ср – процентна концентрація (за умовою задачі); МMgC1 МMgC1 тоді См = Отже, визначаємо осмотичний тиск розчину
Росм = 2,5·0,053·8,31·291 = 320,41 кПа. Приклад 3. При розчиненні 2,05 г натрій гідроксиду в 100 г води температура кипіння розчину підвищилася на 0,496 оС. Визначити ступінь дисоціації розчиненої речовини, якщо Кк = 0,52 К/моль. Розв’язання. Ступінь дисоціації
де ί – ізотонічний коефіцієнт; k – кількість іонів, що утворюється при дисоціації однієї молекули електроліту. Натрій гідроксид при розчиненні дисоціює на два іони:
NaOH отже, k = 2. Збільшення температури кипіння розчину (ΔТк) порівняно з температурою кипіння чистого розчинника виражається формулою
ΔТк = ίКкСg,
де Сg – моляльна концентрація розчину. Звідки ί = Для розрахунку ί треба обчислити Сg. Моляльна концентрація – це кількість молей розчиненої речовини в 1000 г розчинника. За умовою задачі в 100 г води розчинено 2,05 г натрій гідроксиду. Складаємо пропорцію: 2,05 г NaOH – 100 г H2О m г NaOH – 1000 г H2О,
звідки m =
Знаходимо число молей у 1000 г розчинника (Сg):
Сg =
де M (NaOH) = 23 + 16 + 1 = 40 г/моль. Тоді Сg =
Обчислюємо ізотонічний коефіцієнт
ί =
Підставляємо числові значення і визначаємо ступінь дисоціації NaOH:
Приклад 4. Ступінь дисоціації оцтової кислоти в 0,1М розчині дорівнює 1,32·10-2. Знайти константу дисоціації кислоти. Розв’язання. Підставляємо наведені в задачі дані в рівняння закону розведення
Розрахування за наближеною формулою
приводить до приблизного значення
Кдис =(1,32·10-2)2∙0,1=1,74·10-5. Приклад 5. Константа дисоціації ціановодневої (синильної) кислоти дорівнює 7,9∙10-10. Знайти ступінь дисоціації HCN в 0,001М розчині. Розв’язання. Оскільки константа дисоціації HCN дуже мала, то для розрахування можна скористатися наближеною формулою:
Питання для самоперевірки 1. У чому суть теорії електролітичної дисоціації? 2. Дайте визначення ізотонічного коефіцієнта. 3. Що називається ступенем дисоціації електроліту? 4. Які електроліти сильні, а які слабкі? 5. Константа дисоціації слабкого електроліту, її визначення. 6. Сформулюйте закон розведення слабких електролітів, напишіть його математичний вираз. Контрольні завдання 9.1. Знайдіть ізотонічний коефіцієнт для розчину, що вміщує 0,1 моля MgCl2 у 1000 г води, враховуючи, що цей розчин замерзає при –0,461 оС. 9.2. Осмотичний тиск 0,1 н. розчину поташу К2СО3 дорівнює 2,69 атм при 0 оС. Визначте ступінь дисоціації K2СO3 в розчині. 9.3. Знайдіть ізотонічний коефіцієнт для молярного розчину електроліту, молекула якого дисоціює на три іони, знаючи, що 1 л цього розчину вміщує 6,38∙1023 частинок (молекул та іонів) розчинної речовини. 9.4. Яким повинен бути осмотичний тиск 0,1 н. розчину калій хлориду, якщо ступінь дисоціації КCl у цьому розчині дорівнює 80 %? 9.5. При якій температурі повинен замерзати розчин, що вміщує 2 моля натрій хлориду на 1000 г води, якщо ступінь дисоціації NаCl у цьому розчині дорівнює 70 %? 9.6. Осмотичний тиск 0,04М розчину електроліту дорівнює 2,15 атм при 0 оС. Ступінь дисоціації електроліту в цьому розчині 70 %. На скільки іонів дисоціює молекула електроліту?
Вивчення цього матеріалу допоможе студентам зрозуміти закономірності властивостей розчинів електролітів, мати уявлення про ступінь та константу дисоціації слабких електролітів.
Поиск по сайту: |
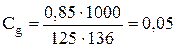 моля.
моля.

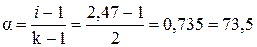 %.
%. Mg+2 + 2C1–.
Mg+2 + 2C1–.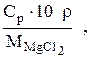
 – молярна маса розчиненої речовини
– молярна маса розчиненої речовини 0,053 моль/л.
0,053 моль/л. обчислюємо за формулою
обчислюємо за формулою

 .
. (г).
(г).
 .
.
 = 87%.
= 87%.
 м
м .
.