 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теорія електролітичної дисоціації
У 1805 р. Ф.Гротгус висловив думку, що в розчинах електролітів електричні заряди переносяться вільними іонами. При цьому він припускав, що розпад розчинених частинок на іони проходить лише під дією електричного струму. Ці припущення були загальноприйнятні до 80-х років ХІХ століття. Р.Ленц висловив думку (1878 р.), що молекули розчинених речовин уже при розчиненні можуть розпадатись або утворювати сполуки між собою або з молекулами розчинника. При розгляданні причин занадто високого осмотичного тиску в розчинах електролітів природньо було припустити, що молекули розчиненої речовини розпадаються на якісь більш дрібні частинки так, що загальне число частинок у розчині зростає. А оскільки осмотичний тиск залежить від числа частинок розчиненої речовини, то із збільшенням їх він підвищується. Таке припущення було вперше висунуно в 1887 р. шведським ученим С. Арреніусом і лягло в основу його теорії електролітичної дисоціації, яка пояснює поведінку кислот, основ та солей у водних розчинах. Водні розчини солей, кислот та основ проводять електричний струм, що обумовлено наявністю в розчинах носіїв електричного заряду. Речовини, що розпадаються в розчинах на іони, називають електролітами. Суть теорії електролітичної дисоціації зводиться до такого: 1. При розчиненні у воді електроліти розпадаються (дисоціюють) на позитивно й негативно заряджені іони. 2. Під дією електричного струму позитивно заряджені іони рухаються до катоду, а негативно заряджені – до аноду. 3. Не всі електроліти в однаковому ступені розпадаються на іони. Повнота розпаду залежить від природи електроліту, його концентрації та температури. Позитивно заряджені іони називають катіонами, наприклад H+, Cu2+, Fe3+, негативно заряджені – аніонами, наприклад Cl¯, SO42–, OH¯. Як і молекули розчинника, іони у розчині знаходяться в стані невпорядкованого теплового руху. Процес електролітичної дисоціації зображають, у вигляді хімічного рівняння, наприклад: HCl
Розпад електролітів на іони пояснює відхилення від законів Вант-Гоффа і Рауля. Так, у розведеному розчині барій хлориду, який дисоціює за рівнянням
BaCl2
осмотичний тиск буде втричі більший від разрахованого за законом Вант-Гоффа, оскільки число частинок у розчині виявляється втричі більшим, ніж у випадку, коли б BaCl2 знаходився в ньому у вигляді молекули. Теорія електролітичної дисоціації пояснює багато явищ, але не враховує всієї складності їх у розчинах. Вона розглядає іони як вільні незалежні від молекул розчинника частинки. Теорії Арреніуса протистояла хімічна або гідратна теорія Менделєєва, в основі якої лежить уявлення про взаємодію розчиненої речовини з розчинником. У подоланні протиріччя, що виникло, велика заслуга належить російському вченому І.А. Каблукову, який уперше висловив припущення про гідратацію іонів. Розвиток цієї ідеї спричинив об’єднання теорій С. Арреніуса і Д.І. Менделєєва. Процес електролітичної дисоціації солей, кислот та основ є оборотним і зображається так:
Al2(SO4)3
H2SO4
Ca(OH)2
Досвід показує, що розпад молекул солей, кислот і основ на іони відбувається тільки в розчинниках, молекули яких полярні, а властивостями електроліту володіють речовини із сильно полярними та іонними зв’язками. Розглянемо дисоціацію речовини з іонною структурою (рис. 27). Коли кристал солі, наприклад калій хлориду, потрапляє у воду, то розташовані на його поверхні іони притягують до себе молекули води (іон – дипольна взаємодія). До іонів калію молекули води притягуються своїми негативними полюсами, а до іонів хлору – позитивними. Молекули води притягують до себе іони солі. Теплового коливання диполів води та іонів у ґратці електроліту виявляється достатньо для відриву іонів від кристалічної ґратки й переходу їх у розчин у вигляді гідрат-іонів (у загальному випадку – у вигляді сольват-іонів).
Рис. 27. Схема електролітичної дисоціації молекул калій хлориду у водному розчині
Інакше проходить дисоціація полярних молекул (рис. 28):
Молекули води, що притягуються до кінців полярної молекули (диполь – дипольна взаємодія), викликають розходження її полюсів – поляризують молекулу. Така поляризація у сполученні з коливальним тепловим рухом атомів у розглянутій молекулі, а також з безперервним тепловим рухом молекул води, що її оточують, приводить зрештою до розпаду полярної молекули на іони. Як і у випадку розчинення іонного кристалу, ці іони гідратуються. При цьому іон Н+ виявляється міцно зв’язаним у іон гідроксонію Н3О+. Існують й інші форми гідроксонію: Н5О2+, Н7О3+, Н9О4+. Дисоціації речовин як іонної, так і молекулярної будови сприяє полярність молекул розчинника.
Поиск по сайту: |
 H+ + Cl¯.
H+ + Cl¯.
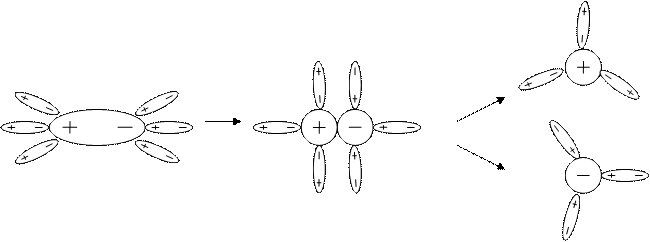
 Рис. 28. Схема електролітичної дисоціації полярної молекули у водному розчині
Рис. 28. Схема електролітичної дисоціації полярної молекули у водному розчині