 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Способы выражения концентрации растворовСтр 1 из 2Следующая ⇒
Методические указания к выполнению практического занятия по теме «Растворы» для студентов лечебного, педиатрического и стоматологического факультетов. Растворы - гомогенные (однородные) системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции. Растворителем считают тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы (твердое вещество) растворителем является вода. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. Классификация растворов.Растворы веществ с молекулярной массой меньше 5000г/моль называют растворами низкомолекулярных соединений (НМС), больше 5000 г/моль - растворы высокомолекулярных соединений (ВМС). По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на три класса - растворы электролитов, неэлектролитов. Растворы электролитов - растворы диссоциирующих на ионы солей, кислот и оснований. Электропроводность растворов электролитов выше, чем растворителя. Например, растворы KNO3, НCl, KOH. Растворы неэлектролитов - растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электропроводность растворов неэлектролитов мало отличается от растворителя. В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя). Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают:
Таким образом, если одно вещество диспергировать (разрушать) в другом, то, в зависимости от размера частиц диспергируемого вещества, можно получить системы трёх типов: I. Взвеси – это дисперсные системы, в которых размеры распределённых частиц сравнительно велики (10 –7 – 10 –5 м). Взвеси делятся на суспезии и эмульсии; в первых распределённое вещество твёрдое, во вторых – жидкое. Частицы взвесий видны простым глазом или в обычный оптический микроскоп. Взвеси – системы мутные и непрозрачные. Взвеси неустойчивы, частицы диспергированного вещества выпадают в осадок (песок + вода), а если плотность диспергированного вещества меньше плотности среды, то диспергированное вещество всплывает (глина + масло). Процесс разделения взвесей называется седиментацией (для суспензий) и расслоением(для эмульсий). II. Коллоидные системы – это такие дисперсные системы, в которых частицы распределённого вещества имеют размеры порядка 10 –9 – 10 –7 м. Каждая такая частица может содержать большое число атомов или молекул. Такие частицы невидимы через обычный микроскоп, но видимы в ультрамикроскоп, где свет падает сбоку или сзади, в результате чего в поле зрения видны светлые точки, возникающие в результате рассеяния света диспергированными частицами. III. Истинные растворы или просто растворы – это дисперсные системы, в которых диспергированное вещество распределено в среде в виде молекул или ионов; частицы имеют размеры порядка 10 –10 – 10 –7 м. Растворы системы однородные, устойчивые.
Способы выражения концентрации растворов. Способы выражения концентрации растворов. I.ω - массовая доля (процентная) концентрация, показывает сколько грамм растворённого вещества содержится в 100 г раствора и выражается формулой: m (р-ра) – масса раствора,m (р-ра) = m (р-ля) + m (вещ-ва) Пример: ω(С6Н12О6) = 10%. Это означает, что в 100 г раствора глюкозы содержится 10 г С6Н12О6 и 90 г Н2О. II. CМилиМ – молярная концентрация, показывает какое количество молей растворённого вещества содержится в одном литре раствора и выражается формулой: где n (X) – количество молей растворённого вещ-ва, V – объём раствора в литрах. Пример: 2М NaOH – двумолярный р-р NaOH. Это означает, что в 1 л данного раствора содержится 2 моля NaOH. 0,1М – децимолярный р-р, 0,01М – сантимолярный р-р, 0,001М – миллимолярный р-р. III. СN или N, – нормальная (эквивалентная) концентрация показывает количество эквивалентов растворённого вещества в одном литре раствора и выражается формулой: где nэ (X) – количество эквивалентов в-ва (Х), V – объём раствора в литрах. Пример: 0,1 N НС1 – децанормальный р-р НС1. это означает, что в 1 л данного раствора содержится 0,1 эквивалента НС1. IV. T. t –титрованная концентрация (титр) показывает сколько грамм растворённого вещества содержится в одном мл раствора и выражается формулой: где m (в-ва) – масса вещества в г, V – объём р-ра в мл.
где N – нормальная концентрация, МЭ (Х) – моль-эквивалент вещества (частиц) Х. Пример: Т (Н2SO4) = 0,05 г/мл. Это означает, что в 1 мл данного раствора содержится 0,05 г Н2SO4.
Поиск по сайту: |
 , где m (вещ-ва) – масса вещества,
, где m (вещ-ва) – масса вещества,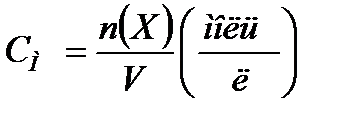 ,
, ,
, ,
, ,
,