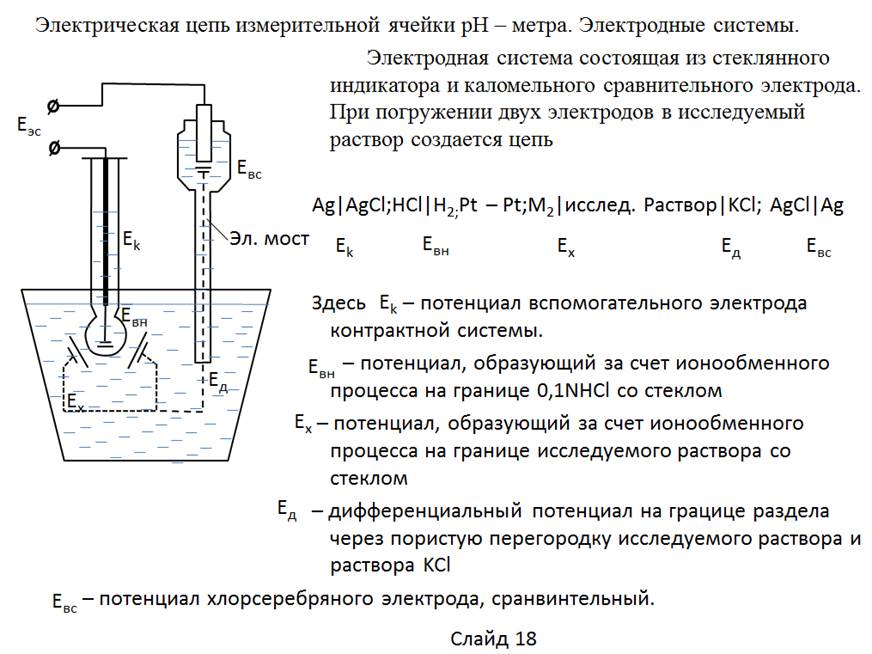
|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Некоторые особенности стеклянных электродов ⇐ ПредыдущаяСтр 2 из 2
1. Потенциал асимметрии Причины: пьезоэлектрическое явление, возникающие вследствие различных натяжений на внешней и внутренней стороне мембраны при быстром охлаждении; при изготовлении электрода происходит неодинаковое выгорание некоторых химических элементов, составляющих электродное стекло. Стараются делать мембраны более тонкостенными, насколько это позволяют соображения прочности. Только что изготовленный электрод имеет как правило больший потенциал асимметрии, чем находившийся некоторое время в воде или растворе. Потенциал асимметрии практически не влияет на наклон водородной функции, а перемещает её параллельно идеальной.
Слайд 10 2. При изменении температуры
Получим пучок прямых пересекающихся в одной точке при некотором значении рН (исходя из уравнения). Электроды из известково-натриевого стекла работают нормально лишь в интервале температур определенном: 20 – 60 °С . В последнее время разработаны рецепты стекол пригодных для работы при более высоких температурах 100 °С и даже выше.
Слайд 11 3. Сопротивление стекла Сопротивление стекла электрода сильно зависит от температуры, причем при понижении температуры оно резко возрастает.
Высокое сопротивление вызывает значительные трудности изоляции цепи стеклянного электрода во избежание недопустимых утечек.
Слайд 12 4. Аномалия стеклянных электродов в сильно – кислой и сильно – щелочной области
Исходным в теории Никольского является предположение о доминирующей роли ионного обмена, являющегося причиной появления разности потенциалов на границе стекло – раствора. Т.е. потенциал стеклянного электрода изменяется лишь под влиянием ионов, способных передвигаться в стекле. Структура стекла представляется как неподвижный анионовый скелет, внутри которого могут двигаться только катионы, анионы же вследствие одноименности зарядов в стекло не проникают. Щелочные металлы (Na+, Zi+ ) располагаются внутри силикатной решетки. При погружении стеклянного электрода в раствор эти ионы вытесняются более подвижными и имеющими L меньший радиус ионами водорода, т.е. происходит процесс выщелачивания стекла. Такой процесс продолжается до наступления состояния равновесия, которое зависит от активной концентрации ионов щелочного металла и ионов водорода в растворе, а также от прочности их связи в стекле и растворе. Слайд 13 Если раствор кислый и в избытке содержатся ионы Н2 то процесс выщелачивания происходит очень полно и стеклянный электрод приобретает полностью свойства водородного. Иной результат при погружении в щелочную среду, особенно при большой концентрации щелочного металла. Здесь свободные места в кристаллической решетке стекла будут занимать не ионы водорода, а щелочного металла. И процесс идет тем интенсивнее, чем меньше радиус катиона из раствора по сравнению с радиусом катиона щелочного металла стекла. Щелочные ионы Li+ – 0,78 Å; Na+ – 0,98 Å; К+ – 1,38 Å; Cs+ – 1,65 Å.
Отсюда видно почему в значительной области изменения рН характеристика стеклянного электрода полностью совпадает с характеристикой водородного электрода. И лишь в сильно кислых и сильно щелочных областях у водородной функции стеклянного электрода наблюдаются отклонения, называемые соответственно кислотной и щелочной ошибкой, которые зависят главным образом от химического состава стекла.
Слайд 14 По мере развития теоретических и экспериментальных исследований были созданы специальные сорта стекла, пригодные для измерения во всей области значений от 0 до 14 рН, в том числе и при высоких температурах растворов. Беневольский предложил ряд рецептур стекол марки 5079 для применения в различных условиях:
В сильно щелочных растворах, особенно при большой концентрации в них ионов Na равновесный потенциал устанавливается при почти полном сохранении своих мест ионами Na в поверхностном слое стекла и здесь электрод проявляет натриевую функцию.
Слайд 15 Поэтому на основании изложенных представлений Никольский предложил уравнение для потенциала стеклянного электрода: где а – активность ионов в растворе с – концентрация ионов в стекле Константа «К» характеризует относительное сродство к стеклу ионов водорода и ионов щелочного металла и зависит от состава стекла. Как показывают исследования при наличии в стекле одних компонентов «сродство стекла» по отношению к ионам щелочного металла будет мало по сравнению с ионами водорода. При этом «К» будет иметь малое значение:
Слайд 16 При этом потенциал стеклянного электрода в широкой области рН будет определяться уравнением:
Таким образом ионообменная теория стеклянного электрода теоретически обосновывает возможность перехода стеклянного электрода от водородной фракции к натриевой.
Слайд 17
Поиск по сайту: |

 При измерении температуры контролируемого раствора величина электродного потенциала стеклянного электрода изменяется вследствие изменения константы RT/F в уравнении Нернста. Изменение Е в зависимости от температуры вызывает изменение наклона характеристик стеклянного электрода. Аналогично водородному изменение наклона характеристики от температуры ΔЕ/t называется температурным коэффициентом и имеет тоже численное значение
При измерении температуры контролируемого раствора величина электродного потенциала стеклянного электрода изменяется вследствие изменения константы RT/F в уравнении Нернста. Изменение Е в зависимости от температуры вызывает изменение наклона характеристик стеклянного электрода. Аналогично водородному изменение наклона характеристики от температуры ΔЕ/t называется температурным коэффициентом и имеет тоже численное значение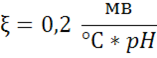
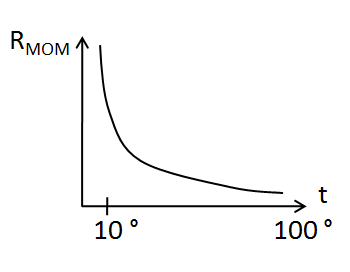 Стекло играет роль проводника электрического тока, прохождение тока через стекло обусловлено наличием свободных ионов. При снижении температуры сопротивление прогрессивно возрастает. Под сопротивлением стеклянного электрода принято считать сопротивление их постоянному току. На сопротивление стеклянных электродов влияет также содержание воды в стекле. В результате вымачивания электродов сопротивление их снижается.
Стекло играет роль проводника электрического тока, прохождение тока через стекло обусловлено наличием свободных ионов. При снижении температуры сопротивление прогрессивно возрастает. Под сопротивлением стеклянного электрода принято считать сопротивление их постоянному току. На сопротивление стеклянных электродов влияет также содержание воды в стекле. В результате вымачивания электродов сопротивление их снижается. Наиболее полной и общепризнанной в настоящее время считается теория стеклянного электрода, созданная советским ученым Б.П. Никольским.
Наиболее полной и общепризнанной в настоящее время считается теория стеклянного электрода, созданная советским ученым Б.П. Никольским. Наименее восприимчиво по отношению к щелочным катионам в растворе должно быть литиевое стекло. Наибольшее отклонение имеют натриевые стекла в растворах содержащих ионы Na+ и Zi+ .
Наименее восприимчиво по отношению к щелочным катионам в растворе должно быть литиевое стекло. Наибольшее отклонение имеют натриевые стекла в растворах содержащих ионы Na+ и Zi+ .

 и
и 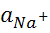 – активность ионов Н и Na в растворе; К – константа равновесия или обмена ионов водорода и натрия, характеризующая разницу в проточности связи указанных ионов со стеклом по сравнению со связью из с растворителем в растворе:
– активность ионов Н и Na в растворе; К – константа равновесия или обмена ионов водорода и натрия, характеризующая разницу в проточности связи указанных ионов со стеклом по сравнению со связью из с растворителем в растворе: