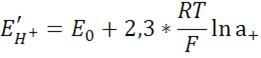|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Измерительная ячейка при потенциометрических измеренияхСтр 1 из 2Следующая ⇒
Потенциометрия Потенциометрия – методы анализа, основанные на измерении электродных потенциалов. Сущность метода – в возникновении электродного потенциала на границах металлического раствора. Двойной электродный слой – чем больше катионов переходит в раствор, тем больше отрицательных зарядов на металле. Величина потенциала определяется законом Нернста:
Уравнение справедливо не только для узкого кл., но и более широкого. Но величина потенциала зависит от концентрации потенциала – определяющих ионов.
Слайд 1 Процесс диссоциации и рекомбинации Динамическое равновесие , по закону действующих масс. V1=K1[H2O]; V2=K2[H+][OH-]; K1[H2O]= K2[H+][OH-] – при равновесии;
KH2O=[H+][OH-] – ионное произведение воды=константе при t-const; KH2O=1,0*10-14 при 22 °С. В нейтральной: [H+]=[OH-]= В кислой: [H+]>10-7 Слайд 2 pH=-lg CH3O=-lg[H+]; рН – это отрицательный десятичный логарифм концентрации ионов водорода. pOH=-lg[OH-]; pKH2O=-lg KH2O lg[H+]+ lg[OH-]= lg KH2O=-14 pH+pOH= pKH2O=14 Нейтральная среда: pH=-lg[H+]=7 В нейтральном растворе ионы взаимодействуют под влиянием электростатических сил. И с увеличением концентрации их степень диссоциации уменьшается относительно.
Активность – это концентрация составляющих, находящихся в ионизированном состоянии (диссоциированном).
При изменении t изменяется и KH2O и соответственно рН. При t=0 °С –pH(нейтральное)=7,97; При 100 °С – pH=6,12 Слайд 3 Буферные свойства растворов Измерение рН, как и измерение любой другой величины, требует стандартизации шкалы рН, т.е. наличие на шкале реперных точек обеспечивающих воспроизводимые измерения. В настоящее время шкала рН основана на воспроизводимых значениях пяти эталонных буферных растворов. Буферные растворы это такие растворы, которые характеризуются определенной активностью ионов водорода, которая почти не зависит от разбавления водой и мало изменяется даже при прибавлении небольшого количества кислоты или щелочи. Очень важно знать, в каких пределах раствор сохраняет свои буферные свойства. Свойства буферной системы характеризуются буферной емкостью, которая равна тому количеству кислоты или щелочи, которое надо добавить в раствор, чтобы изменить его рН на 1.
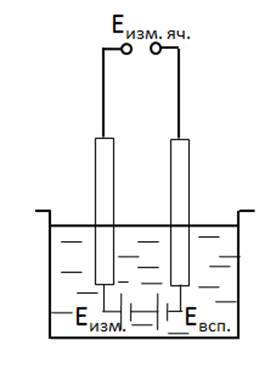
Слайд 4 Измерительная ячейка при потенциометрических измерениях.
Гальваническая или концентрационная цепь, состоит из 2-х электродов: измерительного и сравнительного.
Слайд 5 Водородный электрод
Электрометрический метод измерения активности ионов водорода как единственно пригодном для непрерывного автоматического измерения величины рН. Водород как известно проявляет свойства металла и к нему применимы все выводы теории Нернста, согласно которой для определения активности ионов H+ в растворе в него следует поместить пластинку водорода.
E0 – потенциал нормального водородного электрода Е=-0,058 рН[в] – водородная функция, линейна на всём диапазон.
Слайд 6
Поиск по сайту: |
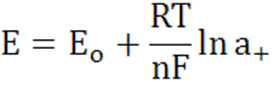
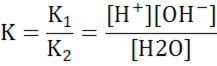 – константа равновесия реакции диссоциации воды;
– константа равновесия реакции диссоциации воды;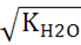 =10-7
=10-7 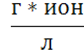


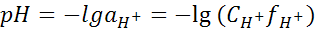
 Уравнение Нернста определяет величину потенциала электрода как функцию активности потенциал определяющих ионов.
Уравнение Нернста определяет величину потенциала электрода как функцию активности потенциал определяющих ионов.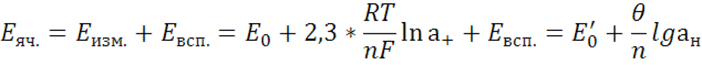
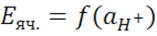 – однозначно определяет величину активности по измеренному значению ЭДС.
– однозначно определяет величину активности по измеренному значению ЭДС.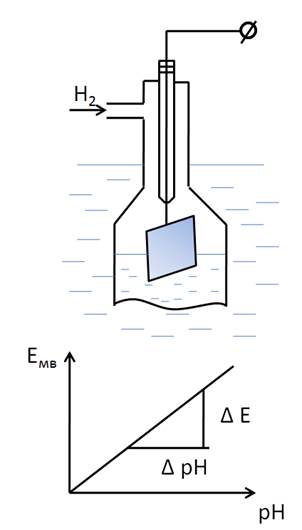 H2=2H++2e-
H2=2H++2e-