 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Поверхнево-активні речовини і адсорбція на рухомій межі поділу фаз
Із формули (11.1) випливає, що поверхнева енергія системи залежить від поверхневого натягу та площі поверхні поділу фаз. Було зазначено, що запас вільної поверхневої енергії чистої рідини можна змінити, змінюючи її поверхню. Для розчинів цього можна досягти лише зміною поверхневого натягу. Отже, надлишок вільної поверхневої енергії на межі поділу фаз у розчинах компенсується самочинним зменшенням поверхневого натягу, яке відбувається під час адсорбції. Адсорбція - це самочинний процес зміни концентрації компонентів у поверхневому шарі Cs порівняно з їх концентрацією в об'ємі фази Cv. Загалом залежно від природи розчиненої речовини поверхневий натяг розчину може зменшуватись, збільшуватись або не змінюватись, порівняно з поверхневим натягом розчинника. Найпоширенішим розчинником у неживій і живій природі є вода. Тому саме стосовно води усі речовини поділяють на поверхнево-активні, поверхнево-неактивні (поверхнево-інактивні) та поверхнево-індиферентні. Такий поділ умовний, оскільки значна кількість речовин, які є поверхнево-активними у водних розчинах, - поверхнево-неактивні в інших розчинниках.
Така властивість ПАР визначається особливістю їх будови . У молекулі ПАР розрізняють дві частини: неполярну (вуглеводневий ланцюг) та полярну (функціональна група, наприклад —ОН, —СООН, —NH2, —S03H та ін.). Тому до ПАР належать спирти, жир- ні кислоти та їх солі (мила), сульфокислоти та інші класи органічних сполук. Вуглеводнева частина молекули гідрофобна (відштовхує воду), а полярна група, яка має значний дипольний момент і інтенсивно взаємодіє з водою, є гідрофільною (тобто притягує воду). Молекули, що мають таку будову, називають дифіль-ними. Найвигіднішим положенням дифільних молекул є їх розміщення на межі поділу фаз, оскільки полярна група втягується водою, а неполярний вуглеводневий радикал виштовхується з неї . У дифільних молекул з короткою гідрофобною частиною (нижчі представники наведених гомологічних рядів) переважають гідрофільні властивості, тому вони легко розчиняються у воді. Зі збільшенням довжини вуглеводневого радикалу посилюються гідрофобні властивості речовин, знижується їх розчинність у воді і зменшується власний поверхневий натяг.
Поверхнево-індиферентними (ПІР) називають речовини, що не змінюютьповерхневий натяг розчинника <
Як орієнтуються молекули ПАР у поверхневому шарі і як змінюватиметься при цьому поверхневий натяг? Якщо концентрація дифільних молекул ПАР невелика, то всі вони розміщуються на межі поділу так, що вуглеводневі радикали знаходяться на поверхні води і орієнтовані щодо неї під кутом, близьким до 10°. Таке розміщення можливе завдяки гнучкості вуглеводневого ланцюга .
При збільшенні концентрації молекули ПАР набувають чіткішої орієнтації , за певної їх концентрації розміщуються чітко вертикально , утворюючи насичений мономолекулярний адсорбційний шар. Висновок про те, що в мономолекулярному поверхневому шарі вуглеводневі радикали ПАР орієнтовані вертикально, було підтверджено рентгенографічними дослідженнями. Поверхневу плівку з одного шару молекул ПАР, що утворюється на межі між водним розчином ПАР і повітрям, органічною рідиною або твердою поверхнею, називають моношаром.
Як змінюється поверхневий натяг зі збільшенням концентрації розчиненої речовини (ПАР, ПНР, ПІР)? Графіки залежності а— С називають ізотермою поверхневого натягуі можуть мати вигляд, зображений на рис. 11.4. Для поверхнево-неактивних речовин зі збільшенням концентрації поверхневий натяг зростає (крива 1), для поверхнево-індиферентних - не змінюється (крива 2), а для поверхнево-активних - зменшується (крива 3). Аналіз ізотерм поверхневого натягу свідчить, що всі криві починаються з однієї точки, яка відповідає поверхневому натягу води. При добавлянні до води перших порцій ПАР останні майже повністю розподіляються у поверхневому шарі і поверхневий натяг різко зменшується. Момент утво- рення насиченого мономолекулярного шару ПАР відповідає мінімуму поверхневого натягу . Поверхнева активність. Правило Дюкло—Траубе.Здатність поверхнево-активних речовин знижувати поверхневий натяг кількісно виражають поверхневою активністю. її визначають як відношення зміни поверхневого натягу до зміни концентрації ПАР і на честь Гіббса позначають буквою G:
Якщо поверхневий натяг зі збільшенням концентрації розчиненої речовини зменшується, то
що спостерігається для ПАР. Для ПНР поверхнева активність є додатною величиною: оскільки зі зростанням концентраціїтаких речовин поверхневий натяг також збільшується. Від чого залежить поверхнева активність ПАР? Виявилося, що поверхнева активність дифільних молекул залежить від довжини вуглеводневого радикалу. Біолог П. Дюкло та фізіолог J. Траубе (1831) сформулювали таке правило: у певному гомологічному ряду (жирних кислот, спиртів та інших дифільних сполук) у водних розчинах однакової концентрації зі збільшенням довжини вуглеводневого радикалу на одну групу —СН2 — поверхнева активність збільшується у 3-3,5раза, тобто
де G - поверхнева активність; п - число груп —СН2— ; f$ - коефіцієнт Траубе. Правило Дюкло-Траубе найточніше виконується за низьких концентрацій розчинених речовин. Із нього випливає важливий висновок: площа, яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається сталою в межах гомологічного ряду. Наприклад, для спиртів вона становить 0,25 нм2 (0,25-НГ18 м2), для кислот - 0,205 нм2 (0,205-10"18 м2). Згідно з правилом Дюкло-Траубе змінюється анальгетична та наркотична дія відповідних лікарських препаратів.
Мінімальне значення поверхневого натягу на ізотермах відповідає моменту повного насичення поверхневого шару молекулами ПАР, тобто максимальній адсорбції (Гтах). Графік залежності величини адсорбції від концентрації Г = f(C) називають ізотермою адсорбції. Наведені графіки показують, що зі збільшенням концентрації ПАРадсорбція зростає, причому за малих концентрацій залежність пропорційна, а за високих - адсорбція досягає свого граничного значення Гтах і потім не змінюється. Величина Гтах є сталою для всіх чле- нів гомологічного ряду, оскільки визначається тільки природою функціональних груп. Рівняння адсорбції Гіббса та його аналіз.На сьогодні ще не розроблено надійних методів визначення надлишку розчиненої речовини у поверхневому шарі, проте можна експериментально точно виміряти поверхневий натяг розчинів ПАРрізних концентрацій, а потім обчислити величину адсорбції за рівнянням Гіббса (1878):
Рівняння Гіббса є математичним обґрунтуванням загального правила: речовина, що зменшує поверхневий натяг, концентрується у поверхневому шарі.
адсорбуються на межі поділу, а розподіляються в усьому об'ємі розчину.
Поиск по сайту: |

 Поверхнево-активні речовини (ПАР) - це сполуки, що адсорбуються на поверхні поділу фаз (CS>CV) і зменшують поверхневий натяг води ПАР поділяють на аніонактивні, катюнактивні, неюногенні та амфолітні (амфотерні).
Поверхнево-активні речовини (ПАР) - це сполуки, що адсорбуються на поверхні поділу фаз (CS>CV) і зменшують поверхневий натяг води ПАР поділяють на аніонактивні, катюнактивні, неюногенні та амфолітні (амфотерні). Поверхнево-неактивними (ПНР) називають речовини, які збільшують поверхневий натяг води і концентруються в об'ємі розчину (CS<CV). До поверхнево-неактивних речовин належать неорганічні кислоти, основи, солі та деякі дуже полярні органічні сполуки (гліцерол, амінокислоти тощо).
Поверхнево-неактивними (ПНР) називають речовини, які збільшують поверхневий натяг води і концентруються в об'ємі розчину (CS<CV). До поверхнево-неактивних речовин належать неорганічні кислоти, основи, солі та деякі дуже полярні органічні сполуки (гліцерол, амінокислоти тощо).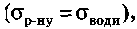 оскільки їх поверхнева й об'ємна концентрації однакові (CS=CV). Прикладом таких речовин є сахароза та інші вуглеводи, форміатна кислота НСООН (містить полярну групу, але не має вуглеводневого радикалу).
оскільки їх поверхнева й об'ємна концентрації однакові (CS=CV). Прикладом таких речовин є сахароза та інші вуглеводи, форміатна кислота НСООН (містить полярну групу, але не має вуглеводневого радикалу).


 У Міжнародній системі одиниць (СІ) поверхневу активність вимірюють у Джм/моль або Нм2/моль. Вона показує зменшення поверхневого натягу розчину при зміні концентрації ПАР на одиницю і характеризує адсорбційну здатність речовини.
У Міжнародній системі одиниць (СІ) поверхневу активність вимірюють у Джм/моль або Нм2/моль. Вона показує зменшення поверхневого натягу розчину при зміні концентрації ПАР на одиницю і характеризує адсорбційну здатність речовини.



 де Г - величина адсорбції розчиненої речовини, моль/м , С - загальна концентрація розчину, моль/м3; R - газова стала; Т - абсолютна температура, К; поверхнева активність G, Н-м2/моль.
де Г - величина адсорбції розчиненої речовини, моль/м , С - загальна концентрація розчину, моль/м3; R - газова стала; Т - абсолютна температура, К; поверхнева активність G, Н-м2/моль.
 Аналіз рівняння Гіббса (11.4) підтверджує, що оскільки для ПАР то адсорбція є додатною величиною (Г > 0); для ПНР і адсорбція є від ємною (Г<0), тобто поверхнево-неактивні речовини не
Аналіз рівняння Гіббса (11.4) підтверджує, що оскільки для ПАР то адсорбція є додатною величиною (Г > 0); для ПНР і адсорбція є від ємною (Г<0), тобто поверхнево-неактивні речовини не