|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Поверхнева енергія і поверхневий натягСтр 1 из 5Следующая ⇒
ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ФАЗ. ХРОМАТОГРАФІЯ
Поверхневі явища, їх роль і класифікація У гетерогенних системах на межі поділу фаз відбуваються особливі процеси, що супроводжуються так званими поверхневими явищами. Саме на поверхні поділу фаз відбуваються процеси обміну, синтезу, адсорбції, десорбції, ферментативні реакції тощо, які забезпечують життєдіяльність організмів. Насамперед життя людини починається з дихання, яке відбувається за участю кисню. Він вбирається альвеолами легень, кількість яких досягає сотень мільйонів, а їх загальна поверхня становить приблизно 90 м2, що у 50 разів перевищує поверхню тіла людини. Далі кисень зв'язується гемоглобіном і переноситься червоними кров'яними тільцями - еритроцитами, кількість яких у крові людини досягає 27 трильйонів, а поверхня становить близько 3200 м2. Сумарна поверхня мембран усіх клітин організму людини дуже велика і становить приблизно 15 тис. м2, частка біомембран дорівнює 3/4 маси сухої клітини. Отже, дослідження фізико-хімії поверхневих явищ тісно пов'язане з вивченням цих важливих процесів у живих системах. Активоване вугілля завдяки величезній поверхні (1г вугілля має поверхню 1000 м2) виявляє високу адсорбційну здатність і застосовується у медичній практиці та промисловості для поглинання шкідливих газів, токсинів тощо. Залежно від агрегатного стану контактуючих фаз поверхні поділу класифікують на: • рухомі межі поділу: рідина-газ (Р-Г), рідина-рідина (Р-Р); • нерухомі межі поділу: тверде тіло-газ (Т-Г), тверде тіло-рідина (Т-Р), тверде тіло-тверде тіло (Т-Т). Далі розглянемо види і суть поверхневих процесів, що відбуваються на рухомих і нерухомих межах поділу фаз. Поверхнева енергія і поверхневий натяг Будь-яка гетерогенна система на межі поділу фаз має певний запас вільної поверхневої енергії. Який механізм її виникнення? Розглянемо посудину, в яку
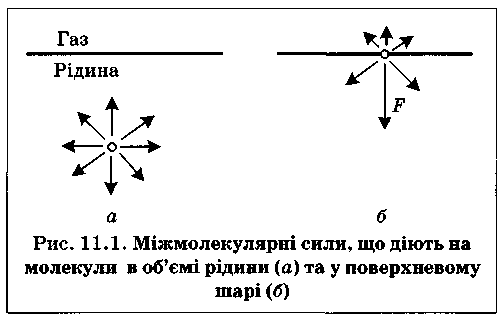
налито рідину Властивості молекул на поверхні поділу рідина-газ (повітря) відрізняються від властивостей молекул в об'ємі рідкої фази. Молекули всередині рідини рівномірно притягуються з усіх боків такими самими за природою молекулами, і силове поле міжмолекулярної взаємодії скомпенсоване (рівнодійна сил дорівнює нулю).
Якщо молекула рідини знаходиться на поверхні поділу фаз , сили міжмолекулярної взаємодії не зрівноважуються, оскільки інтенсивність взаємодії між молекулами рідини значно вища, ніж між молекулами рідини та газу; рівнодійна сил F не дорівнює нулю і напрямлена всередину рідкої фази. Це зумовлює втягування поверхневих молекул углиб рідини. Таким чином, молекули, розташовані на поверхні, мають певний надлишок енергії, який називають вільною поверхневою енергією Gs. Відношення надлишку вільної поверхневої енергії Гіббса до площі поверхні поділу фаз називають поверхневим натягом:
де Gs - вільна поверхнева енергія; S - площа поверхні поділу фаз; а - поверхневий натяг. Його можна визначити як роботу при оборотному ізотермічному процесі, яку потрібно виконати для збільшення поверхні поділу фаз на 1 м2. Виражають в одиницях сили на одиницю довжини (Н/м) або величиною енергії на одиницю площі (Дж/м2). Величину поверхневого натягу визначають експериментально кількома методами: капілярного підняття, максимального тиску бульбашок повітря (метод Ребіндера), сталагмометричним, відриву кільця, втягування пластинки (метод Вільгельмі) та ін. Поверхневий натяг - характерна фізична константа будь-якої чистої рідини за сталої температури. Він тим більший, чим більші полярність молекул рідини і здатність їх утворювати водневі зв'язки. Порівняно з іншими рідинами, поверхневий натяг води є найбільшим . Згідно з другим законом термодинаміки , поверхнева енергія рідини прагне досягти мінімуму. У чистих рідинах такий стан забезпечується зменшенням площі поверхні S. Цим пояснюють кулясту форму крапель води, оскільки поверхня кулі мінімальна. Проте форма крапель у різних рідин різна. У ртуті, поверхневий натяг якої дуже великий (4851СГ3 Н/м), краплі мають форму ідеальної кулі. У води притягання молекул слабше, поверхневий натяг менший (72,75-Ю-3 Н/м) і краплі мають овальну (витягнуту) форму. А спирт, бензен, у яких поверхневий натяг ще менший, розтікаються по поверхні у вигляді плівки. Поверхневий натяг залежить від температури і для багатьох рідин лінійно зменшується з її підвищенням. Це пояснюють тим, що через прискорений рух послаблюються сили притягання молекул і за певної критичної температури (температура кипіння) поверхневий натяг дорівнюватиме нулю - зникне межа поділу, система стане гомогенною, рідина перейде у газуватий стан. Таку закономірність встановив ще Д. Менделєєв.
Поиск по сайту: |