 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Электродные потенциалы и ЭДССтр 1 из 2Следующая ⇒
Химия Химические реакции, вызывающие электрический ток. Электродные потенциалы и электродвижущие силы . Методические указания к выполнению лабораторной работы:
Санкт-Петербург 2015 год Составители: Николаев Ю.С. ,Крылова Т.Е Рецензент канд. техн. наук, доцент Волохов М.А. Содержатся методические указания к выполнению лабораторной работы. Даны примеры решения задач и контрольные задания. Предназначены для всех специальностей, направлений. Подготовлены к публикации кафедрой технической физики, электромеханики и робототехники.
Методические указания предназначены для всех технических специальностей, направлений. Лабораторная работа: Химические реакции, вызывающие электрический ток. Электродные потенциалы и электродвижущие силы Цель работы: ознакомление с механизмами протекания химических реакций, вызывающих электрический ток; расчет и экспериментальное определение электродвижущей силы (ЭДС).
Химические реакции, вызывающие электрический ток. Электродные потенциалы и ЭДС. Устройства, в которых энергия химических реакций превращается в электрическую, называется гальваническими элементами. Для закрытых систем, в которых не изменяется количество вещества, первое начало термодинамики обычно формулируется как
Последний член уравнения отражает «химическую составляющую» в общее изменение энергии системы. Более подробно он рассматривается в курсе химической термодинамики. Работа, совершаемая системой (над системой), может иметь различную природу (mgdh- работа сил тяжести, pdV- работа изменения объема газа и т.д.). Если в системе (над системой) совершается электрическая работа, то «электрическая работа» (работа переноса электрического заряда в электрическом поле) равна Edq, где Е- разность потенциалов (В), dq- количество перенесенного электричества (Кл). При этом максимальная теоретическая электрическая работа может быть достигнута в равновесном процессе ( Энергия химических реакций может переходить в электрическую (гальванические элементы, аккумуляторы при разрядке) и наоборот (электролиз, аккумуляторы при зарядке). Передача электронов от восстановителя к окислителю происходит в окислительно-восстановительных реакциях. Если окислительно-восстановительную реакцию осуществлять так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное перемещение электронов- электрический ток. Механизм возникновения разности потенциалов на поверхности раздела фаз металл-вода, металл-раствор соли металла заключается в том, что узлы кристаллической решетки занимают катионы, между которыми движутся электроны. Если какой-то металл привести в контакт с чистой водой, то полярные молекулы воды вступят во взаимодействие с катионами поверхностного слоя металла что вызовет переход катионов в жидкую фазу. Вследствие этого на металле остается избыток электронов, и возникает отрицательный заряд. Переход первых катионов сопровождается меньшей затратой энергии, чем переход последующих, которые отрываются от поверхности, уже имеющей отрицательный заряд. Поэтому переход катионов в воду быстро прекращается, и между отрицательным заряженным металлом и положительно заряженным раствором устанавливается равновесие. Возникает двойной электрический слой, строение которого напоминает строение конденсатора, состоящего из двух противоположно заряженных обкладок. Между обкладками двойного слоя существует разность потенциалов, или скачок потенциала, или просто электродный потенциал. Электродом называют проводник первого рода, находящийся в контакте с электролитом. Большая часть катионов сосредоточена у поверхности металла. Здесь в тонком слое жидкости (порядка нескольких ангстрем) падает почти весь потенциал. Часть катионов вследствие теплового движения уходят в глубь жидкости, образуя диффузную часть слоя. В диффузной части потенциал падает на меньшее значение и не так резко (по экспоненте). Общее значение потенциала ϕ слагается из его падения в слое (Ψ), непосредственно прилегающем к металлу( плотный слой(l1) и в диффузном (l2)слое (Ψ1):
Рис.1.Схема двойного электрического слоя
Все металлы, опущенные в чистую воду, качественно ведут себя одинаково; в количественном же отношении способность посылать ионы в жидкую фазу у различных металлов выражена неодинаково. В равных условиях она зависит от энергии атомизации (энергии превращения металла в изолированные атомы), энергии ионизации (энергии отрыва электрона от свободного атома и превращения его в положительно заряженный ион) и энергии гидратации (энергии превращения ионов металла в гидратированные ионы). Чем меньше энергия атомизации и энергия ионизации и чем больше энергия гидратации, тем выше способность металла посылать ионы в жидкую фазу. Если металл привести в сопрокосновение с раствором, содержащим ионы данного металла, то металлы могут вести себя по-разному. В случае применения активных металлов наиболее вероятен процесс отрыва от поверхности металла положительных ионов, которые взаимодействуют с полярными молекулами воды и в гидратированном состоянии переходят в раствор:
Поверхность металла заражается отрицательно, а слой раствора- положительно. По мере увеличения концентрации катионов у поверхности в растворе вероятность выхода ионов из металла уменьшается, а вероятность входа их в металл из раствора увеличивается. Если скорости этих процессов становятся равными, то на границе металл-раствор устанавливается динамическое равновесие, т.е. возникает равновесный электродный потенциал. Увеличение концентрации ионов металла в растворе у металлической поверхности смещает равновесие влево и повышает (делает менее отрицательным) электродный потенциал металла. Увеличение концентрации ионов металла в растворе уменьшает также степень размытости диффузной части двойного слоя и значение падения потенциала в диффузной части Из таких пассивных металлов, как медь, серебро, выход ионов в раствор почти не происходит. Поэтому при погружении пассивного металла в раствор его соли преобладает адсорбция ионов металла на поверхности электрода:
В этом случае поверхность металла заряжается положительно, а прилегающий к ней раствор- отрицательно за счет избытка в нем анионов соли.
Металлические электроды условно обозначают:
где вертикальная линия есть граница раздела между электродом и раствором. Кроме металлических электродов, существуют также «газовые» электроды. Благородные металлы Pt, Au и др. в связи с высокой энергией атомизации и энергией ионизации не создают разности потенциалов за счет выхода положительных ионов в раствор. В возникновении скачка потенциала на границе раздела благородный металл- раствор в случае, если последний не содержит катионов данного металла, важную роль играет избирательная адсорбция молекул, атомов или ионов среды. Например, платиновый электрод, покрытый тонким слоем рыхлой платины для увеличения его поверхности, поглощает атомарный водород. При насыщении платины водородом в поверхностном слое устанавливается равновесие
Рис. 2. Водородный электрод(полуэлемент): 1-сосуд; 2-стклянная трбка; 3-платиновый электрод; 4-краны; 5-сифон; 6-гидравлический затвор. Подобно водородному электроду может быть создан кислородный электрод Потенциал может возникать на инертном электроде, который опущен в раствор, содержащий окисленную и восстановленную форму какого-либо соединения. Если в раствор FeCl3 опустить платиновый электрод, то катион Fe3+ отнимает от поверхности платины электрон и превращается в ион Fe2+: Абсолютное значение электродных потенциалов определить невозможно. Поэтому их измеряют, сравнивая с другим таким же электродным потенциалом, значение которого условно принимают нулевым. Роль электрода, потенциал которого в стандартных условиях считается равным нулю, выполняет стандартный водородный электрод, на котором осуществляется процесс В электрохимии электродный потенциал, а также окислительно-восстановительный потенциал и потенциал газового электрода приравнивают к ЭДС цепи, составленной из испытуемого электрода и стандартного водородного электрода. Потенциал называется стандартным (нормальным) в том случае, если активность (концентрация) каждого из участников обратимой электродной реакции равна единице. Если окислитель или восстановитель в системе находятся в газообразном состоянии, то парциальное давление их должно быть равным 1 атм. (760 мм рт. ст. или 1013 гПа). Измерение ЭДС проводят компенсационным методом так, чтобы сила тока в образовавшемся гальваническом элементе была равна нулю (равновесие в системе). Для этого полюса электродов подключают к одноименным полюсам внешнего источника с известной ЭДС. Регулируя сопротивление, подбирают такое значение ЭДС внешнего источника, когда ток в цепи гальванического элемента исчезает. Значение компенсирующей ЭДС в вольтах численно равно стандартному электродному потенциалу ϕ0. Определенные таким образом нормальные электродные потенциалы имеют относительные значения. Если электроны с водородного электрода, абсолютный заряд которого отрицателен, по внешней цепи будет переходить по другой, например, В приложении приведены значения стандартных электродных потенциалов ϕ0 , измеренных по отношению к стандартному водородному электроду. Чем меньше (в алгебраическом смысле) значение ϕ0 ,тем сильнее выражены восстановительные свойства соответствующей электрохимической системы; напротив, чем больше ϕ0 ,тем более выражены окислительные свойства. Зависимость электродного потенциала от концентрации веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста:
Здесь ϕ0 - стандартный электродный потенциал; R- газовая постоянная; Т- абсолютная температура; F- число Фарадея (96485 Кл/моль); n- число электронов, участвующих в электродном процессе;[Ox] и [Red] –активности (концентрации) веществ, принимающих участие в окислительно-восстановительном процессе в окисленной [Ox] и восстановленной [Red] формах. Для обычной при электрохимических измерениях температуры (25oС- 298K), при подстановке значений постоянных величин (R=8,31 Дж/моль·К, F=96485 Кл/моль) уравнение имеет вид: В случае металлических электродов в растворе соли этого металла окисленной формой являются ионы этого металла, следовательно [Ox]=[Men+]. Восстановленной формой являются атомы металла. Поскольку концентрация металла в кристаллической решетке при постоянной температуре [Red]= const ,что строго обосновывается термодинамикой, то:
Для водородного электрода при постоянном парциальном давлении, равном нормальному атмосферному давлению:
Поскольку Из любых двух окислительно-восстановительных систем (например,
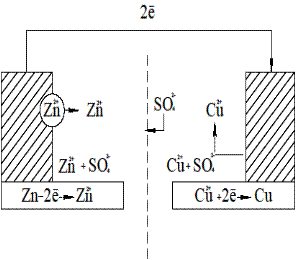
Рис.3.Схема медно-цинкового элемента. ЭК- электролитический ключ (солевой мостик). Этими процессами сохраняется разность потенциалов, обеспечивающая постоянный переход электронов от цинка к меди- электрический ток в цепи. Во внутренней части цепи анионы SO 42-перемещаются от медного электрода к цинковому. Поэтому работа гальванического элемента возможна при замыкании обеих цепей- металлической между электродами для перехода электронов и жидкостной (электролитной) для перехода ионов. Жидкостная цепь замыкается обычно изогнутой стеклянной трубкой (электролитический мостик), заполненной гелем желатина или агар-агара, содержащим электролит. Вместо такого проводника можно применить сосуд с пористой перегородкой, но в этом случае через некоторое время диффузионные процессы изменяют состав электролита и его концентрацию, что влияет на значение электродного потенциала. Правила записи схем гальванического элемента, заключаются в том что записанный слева электрод должен быть отрицательным. Две вертикальные черты означают, что диффузионный потенциал (т.е. скачок потенциала, возникающий при контакте двух растворов электролитов из-за различия скоростей диффузии различных ионов) между растворами устранен.Часто необходимо указывать концентрации растворов ,если они отличаются от стандартной и состав солевого мостика. Например:
Так ,например, если в схеме гальванического элемента используется предыдущая схема ,но растворы электролитов имеют вполне определенные концентрации (отличающиеся от стандартной),то при полной записи схемы необходимо их указание их концентрации. Разность потенциалов может быть создана при использовании одного и того же раствора разной концентрации и одинаковых электродов. В этом случае гальванический элемент называется концентрационным и функционирует за счет выравнивания концентраций растворов:
Так же существуют гальванические элементы с твердым электролитом: ЭДС гальванического элемента(Е) связана с изменением энергии Гиббса окислительно-восстановительная реакция в гальваническом элементе следующим уравнением:
Учитывая, что стандартное изменение энергии Гиббса реакции связано с ее константой равновесия
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и практически постоянная ЭДС, возможность получения больших токов, длительная сохранность и т.д.). Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ. Почти во всех выпускаемых в настоящее время гальванических элементах анод изготавливается из цинка, а для катода применяются оксиды менее активных металлов. Химические источники электрической энергии применяются в различных отраслях техники. В средствах связи (радио, телефон, компьютерная техника) и электроизмерительной аппаратуре они служат источниками электропитания, на автомобилях, самолетах и других механизмах применяются для приведения в действие стартёров и других устройств, в переносных фонарях с их помощью производится освещение.
Поиск по сайту: |
 (где
(где 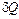 и
и  количество теплоты и работы,
количество теплоты и работы,  изменение внутренней энергии). Или
изменение внутренней энергии). Или  Для систем, где происходит изменение количества вещества (химические реакции), необходимо учесть тот вклад в общую энергию, который они «производят». Если количество вещества i в системе возрастает, то увеличение его количества
Для систем, где происходит изменение количества вещества (химические реакции), необходимо учесть тот вклад в общую энергию, который они «производят». Если количество вещества i в системе возрастает, то увеличение его количества  считается положительным (
считается положительным (  ). Каждому из веществ, участвующих в реакции, отвечает так называемый «химический потенциал»
). Каждому из веществ, участвующих в реакции, отвечает так называемый «химический потенциал»  «отвечающий» за его изменение в энергию системы. Если в реакции участвуют k веществ, то первое начало термодинамики должно быть записано как:
«отвечающий» за его изменение в энергию системы. Если в реакции участвуют k веществ, то первое начало термодинамики должно быть записано как:
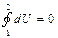 ) при условии, если тепло δQ не будет выделяться (рассеиваться), а вся «химическая работа» (
) при условии, если тепло δQ не будет выделяться (рассеиваться), а вся «химическая работа» (  ) будет полностью переходить в электрическую (Edq). Учитывая, что
) будет полностью переходить в электрическую (Edq). Учитывая, что  где Q- количество теплоты (Дж), I- сила тока (А), R- сопротивление (Ом), t- время (с), величину
где Q- количество теплоты (Дж), I- сила тока (А), R- сопротивление (Ом), t- время (с), величину  можно свести к минимуму за счет увеличения сопротивления.
можно свести к минимуму за счет увеличения сопротивления.

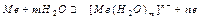

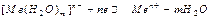




 Если такой водородный электрод находится в растворе, содержащим ионы водорода (рис.2), то на границе раздела двух фаз устанавливается новое равновесие
Если такой водородный электрод находится в растворе, содержащим ионы водорода (рис.2), то на границе раздела двух фаз устанавливается новое равновесие  а суммарный процесс выражается уравнением:
а суммарный процесс выражается уравнением:  Этому равновесию на границе раздела металл-раствор отвечает определенный потенциал платины, зависящий от концентрации ионов водорода и давления газообразного водорода над раствором, в который погружен платиновый электрод. Всякое отклонение его потенциала от равновесного вызывает реакцию
Этому равновесию на границе раздела металл-раствор отвечает определенный потенциал платины, зависящий от концентрации ионов водорода и давления газообразного водорода над раствором, в который погружен платиновый электрод. Всякое отклонение его потенциала от равновесного вызывает реакцию  идущую как в прямом, так и в обратном направлениях.
идущую как в прямом, так и в обратном направлениях.
 на границе раздела фаз которого происходит процесс
на границе раздела фаз которого происходит процесс  или хлорный электрод
или хлорный электрод  c реакцией в двойном электрическом слое
c реакцией в двойном электрическом слое  Платина во всех случаях- не только основа газовых электродов, но и источник или поглотитель электронов. В отличие от водородного, хлорный и кислородный электроды заряжаются положительно вследствие перехода в раствор ионов
Платина во всех случаях- не только основа газовых электродов, но и источник или поглотитель электронов. В отличие от водородного, хлорный и кислородный электроды заряжаются положительно вследствие перехода в раствор ионов  и
и 
 В результате платина получает положительный заряд, а раствор у поверхности ее- отрицательный за счет образовавшегося избытка
В результате платина получает положительный заряд, а раствор у поверхности ее- отрицательный за счет образовавшегося избытка  Равновесие в двойном электрическом слое выразится уравнением
Равновесие в двойном электрическом слое выразится уравнением  Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятнее отдача электрона им в кристаллическую решетку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы хрома
Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона. И, наоборот, чем сильнее восстановительная активность иона, тем вероятнее отдача электрона им в кристаллическую решетку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенциал на платине в растворе, содержащем ионы хрома  В двойном слое устанавливается равновесие
В двойном слое устанавливается равновесие  Потенциал платины в рассмотренных примерах определяется соотношением активных концентраций окисленной и восстановленной форм ионов и характеризует окислительно-восстановительную способность каждой из систем. Поэтому потенциал получил название окислительно-восстановительного.
Потенциал платины в рассмотренных примерах определяется соотношением активных концентраций окисленной и восстановленной форм ионов и характеризует окислительно-восстановительную способность каждой из систем. Поэтому потенциал получил название окислительно-восстановительного. при активности (концентрации) ионов водорода, равной единице, парциальном давлении, равном нормальному атмосферному давлению, и температуре 298К.
при активности (концентрации) ионов водорода, равной единице, парциальном давлении, равном нормальному атмосферному давлению, и температуре 298К. электрод, то у такого электрода положительный потенциал(0,337В). В паре с активными металлами (цинк, железо, магний) водородный электрод играет роль положительного электрода, и для них ϕ0 отрицательный, а поток электронов направлен от металлического электрода к водородному.
электрод, то у такого электрода положительный потенциал(0,337В). В паре с активными металлами (цинк, железо, магний) водородный электрод играет роль положительного электрода, и для них ϕ0 отрицательный, а поток электронов направлен от металлического электрода к водородному.

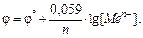

 то
то  или, учитывая что
или, учитывая что  , получаем:
, получаем:  .
. или
или  ) можно составить электрохимическую цепь (рис.3). При этом окислительно-восстановительная система с более отрицательным электродным потенциалом будет служить анодом (Zn), а с более положительным- катодом (Cu). На аноде будет происходить окисление (отдача электронов во внешнюю цепь)- анод заряжается отрицательно. На катоде будет происходить восстановление (прием электронов)- катод заряжается положительно. Вследствие разности потенциалов электроны с анода будут переходить на катод. Это нарушает равновесие в двойном электрическом слое у анода (потенциал повышается) и у катода (потенциал понижается). Обе системы
) можно составить электрохимическую цепь (рис.3). При этом окислительно-восстановительная система с более отрицательным электродным потенциалом будет служить анодом (Zn), а с более положительным- катодом (Cu). На аноде будет происходить окисление (отдача электронов во внешнюю цепь)- анод заряжается отрицательно. На катоде будет происходить восстановление (прием электронов)- катод заряжается положительно. Вследствие разности потенциалов электроны с анода будут переходить на катод. Это нарушает равновесие в двойном электрическом слое у анода (потенциал повышается) и у катода (потенциал понижается). Обе системы  и
и 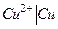 снова будут стремиться к равновесию за счет окисления цинка
снова будут стремиться к равновесию за счет окисления цинка 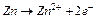 и восстановления меди
и восстановления меди  на медном электроде. Суммарная токообразующая реакция:
на медном электроде. Суммарная токообразующая реакция:


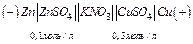

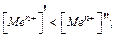





 где n- заряд ионов,
где n- заряд ионов,  -энергия Гиббса.
-энергия Гиббса. получим уравнение, связывающее ЭДС с константой равновесия в гальваническом элементе:
получим уравнение, связывающее ЭДС с константой равновесия в гальваническом элементе: