|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Характеристики аккумулятора Эдисона и свинцового аккумулятора ⇐ ПредыдущаяСтр 3 из 3
Гальванические источники тока одноразового действия представляют собой унифицированный контейнер, в котором находятся электролит, абсорбируемый активным материалом сепаратора, и электроды (анод и катод), поэтому они называются сухими элементами. Этот термин используется применительно ко всем элементам, не содержащим жидкого электролита. К обычным сухими элементам относятся углеродно-цинковые элементы или элементы Лекланше, напряжение которых составляет 1,5 В. Сухие элементы применяются при малых токах и прерывистых режимах работы. Поэтому такие элементы широко используются в телефонных аппаратах, игрушках, системах сигнализации и др.
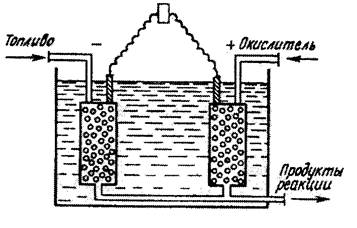
Топливные элементы
В последнее время ведутся исследования направленные на создание элементов, при работе которых расходовались бы дешевые вещества, такие как природный газ, керосин, водород и др. Такие химические элементы называются топливными.
Схема топливного элемента
Топливные элементы осуществляют превращение энергии топлива в электрическую, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимические устройства в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию. В топливных элементах химическая энергия восстановителя (топлива) и окислителя превращаются в электрическую. Открытие в 1838 г. водородно-кислородного топливного элемента принадлежит английскому ученому В. Грову.
На отрицательном электроде протекает реакция 2H2 + 4OH- - 4е = 4H2O, на положительном O2 + 2H2O + 4 e = 4OH-. Суммарное уравнение реакции: O2 + 2H2 = 2H2O. Электроны перемещаются от анода к катоду, а в растворе происходит движение ионов ОН- от катода к аноду. Биохимики установили, что биологический водородно-кислородный топливный элемент «вмонтирован» в каждую живую клетку. Источником водорода в организме служит пища – жиры, белки и углеводы. В желудке, кишечнике, клетках она в конечном итоге превращается до мономеров, которые, в свою очередь, после ряда химических превращений дают водород, присоединенный к молекуле–носителю. Кислород из воздуха попадает в кровь через легкие, соединяется с гемоглобином и разносится по всем тканям. Процесс соединения водорода с кислородом составляет основу биоэнергетики организма. Здесь, в мягких условиях (комнатная температура, нормальное давление, водная среда), химическая энергия с высоким КПД преобразуется в тепловую, механическую (движение мышц), электричество (электрический скат), свет (насекомые, излучающие свет). Для большинства топливных элементов э.д.с. составляет 1,0 - 1,5 В. Топливные элементы уже сейчас используются в спутниках и космических кораблях, перспективно их использование вместо двигателей внутреннего сгорания на транспорте, в большой энергетике и т.п. Человек, в который раз повторил созданное природой устройство для получения энергии. Топливные элементы вселяют надежду на энергетическое будущее.
Электролиз
Электролиз-совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока. На катоде, отрицательно заряженном электроде (-), происходит процесс восстановления, на аноде, положительно заряженном электроде (+) - процесс окисления. Восстановительное и окислительное действие электрического тока сильнее действия химических восстановителей и окислителей. Прибор, в котором проводят электролиз, называется электролизёром или электролитической ванной. На характер течения электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и т.д.). Различают электролиз расплавов и растворов электролитов. В последнем случае в процессе электролиза будут участвовать молекулы воды. Электролиз расплавов.Если в расплав хлорида натрия погрузить инертные электроды (угольные, железные) и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ к катоду, анионы Cℓ- - к аноду.
Окисление происходит на аноде Восстановление происходит на катоде (слова начинаются с гласных «а») (слова начинаются с согласных «к») Анионы – отрицательно заряженные ионы Катионы – положительно заряженные ионы
Ионы натрия Na+, достигнув катода, принимают от него электроны и восстанавливаются; ионы хлора Сl-, отдав электроны аноду, окисляются. Суммарное уравнение электролиза NaСl → Nа+ + Cℓ- (-) катод: Nа+ Nа+ + е → Na (+) анод: Сℓ- 2Сℓ- - 2е → Сℓ2 Суммарная схема процесса электролиза расплава NаСℓ 2NаСℓ → 2Na + Сℓ2. При электролизе расплавов, содержащих кислородсодержащие анионы, на аноде выделяется кислород. Это объясняется образованием при окислении на аноде неустойчивых частиц ОН-, SО42- и т.д., сразу разлагающихся на устойчивый оксид неметалла и кислород. Схема электролиза расплава сульфата натрия может быть представлена следующим образом Na2S04 → 2Nа+ + SО42- (-) катод: Nа+ 2Nа+ + 2е → 2 Nа (+) анод: SО42- SО42- - 2е → SО3 + ½О2 Суммарная схема процесса электролиза расплава Na2S04 Na2S04 → 2Nа + SО3+½О2 . Электролиз растворов. При рассмотрении электролиза водных растворов следует иметь в виду, что кроме молекул электролита, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. В этом случае нужно учитывать величину потенциала процесса восстановления ионов водорода, который зависит от концентрации Н+. В нейтральной среде его значение равно -0,41 В. Последовательность разрядки катионов при электролизе можно установить с помощью электрохимического ряда напряжений. Возможны три случая: 1. Катионы металлов, имеющие величину потенциала значительно более отрицательную, чем -0,41 В (потенциал выделения водорода) не восстанавливаются на катоде (от лития до алюминия включительно), а восстанавливаются молекулы воды; 2. Катионы металлов, имеющие значения стандартных электродных потенциалов близких к значению потенциала выделения водорода (металлы средней части ряда Zn, Сr, Fе, Сd, Ni) восстанавливаются на катоде одновременно с молекулами воды; 3. Катионы металлов, имеющие стандартный электродный потенциал больший, чем потенциал выделения водорода, при электролизе практически полностью восстанавливаются на катоде. Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде будет протекать в порядке уменьшения алгебраической величины стандартного электродного потенциала. Так, из смеси катионов Аg+, Сu2+, Fе2+ первыми будут восстанавливаться катионы серебра (Ео = + 0,80 В), затем катионы меди (Ео = + 0,34 В) и последними - катионы железа (Ео = - 0,44 В). Характер реакций протекающих на аноде зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Различают нерастворимые и растворимые аноды. Нерастворимые аноды изготавливают из графита, платины. При электролизе нерастворимые аноды не посылают электроны во внешнюю цепь, их пополнение осуществляется в результате окисления анионов или молекул воды. При этом анионы бескислородных кислот при их достаточной концентрации окисляются довольно легко. Если же раствор содержит анионы кислородсодержащих кислот (SO42-, NO3-, СО32-, PO43- и др.), то на аноде окисляются не эти ионы, а молекулы воды. В зависимости от рН растворов окисление воды протекает по разному. В щелочной среде имеет место реакция 4ОН- - 4е = О2 + 2Н2О. В кислой или нейтральной среде 2Н2О + 4е = O2 + 4Н+. В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление протекает при очень высоких потенциалах. Например, потенциал окисления ионов SО42- 2SO42- + 2е = S2O82-. равен 2,01 В, что значительно превышает потенциал окисления воды 1,23 В. В случае нерастворимого анода электроны во внешнюю цепь посылает сам анод. Растворимые аноды изготавливают из меди, серебра, цинка, кадмия и др. Рассмотрим несколько примеров электролиза водных растворов электролитов. Электролиз концентрированного раствора иодида калия с угольными электродами. В растворе находятся гидротированные ионы К+ и J-, а так же молекулы воды. При прохождении тока через раствор катионы К+ движутся к катоду, анионы J- - к аноду. Однако реакции, протекающие на электродах, существенно отличаются от реакций, идущих в расплаве соли. Так, на катоде вместо ионов калия (в ряду напряжений он находится до алюминия) восстанавливаются молекулы воды. Схема электролиза раствора КJ с угольными электродами представлена на рисунке.
Схема процесса электролиза КJ (раствора)
Схема электролиза КJ → К+ + J- (-) катод: К+, Н2О 2Н2О +2е → Н2 + 2ОН- (+) анод: J-, H2O 2J- - 2е → J2 Суммарная схема процесса электролиза 2 КJ + 2Н2О → Н2↑ + 2КOH + J2↑. В результате электролиза на катоде выделяется водород на аноде - йод, в прикатодном пространстве накапливается гидроксид калия. Электролиз раствора сульфата калия с угольными электродами. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет восстанавливаться вода, выделяться водород и накапливаться ионы ОН-. У анода выделяется кислород и накапливаются ионы Н+. При перемешивании раствора он будет нейтральным. Схема электролиза
Суммарная схема процесса электролиза
Электролиз водного раствора сульфата калия сводится к электролизу воды
Электролитическое разложение воды
Количество растворенной соли остаeтся постоянным. В рассмотренном примере К2SО4 выполняет роль электролита. Электролиз раствора сульфата цинка с инертными электродами. На катоде одновременно восстанавливаются ионы цинка и молекулы воды (электродный потенциал цинка -0,76 В близок к потенциалу разложения воды -0,41 В). На аноде окисляются молекулы воды и выделяется кислород. Схема электролиза ZnSО4 —>Zn2+ +SO42-
Суммарная схема процесса электролиза
Электролиз раствора нитрата меди с инертными электродами. Стандартный электродный потенциал Сu +0,34 В, поэтому на катоде восстанавливаются ионы Сu2+ и выделяется медь. На аноде окисляются молекулы воды и выделяется кислород. Схема электролиза
Суммарная схема процесса электролиза
Электролиз раствора сульфата никеля с никелевым анодом. Стандартный электродный потенциал Ni -0,25 В. Он несколько больше, чем потенциал разложения воды (-0,41 В), поэтому на катоде в основном происходит восстановление ионов Ni2+ и выделение металла. На аноде - противоположный процесс - окисления металла, так как потенциал никеля намного меньше потенциала окисления воды (1,23 В) и потенциала окисления SO42- ионов (2,01 В). Электролиз в данном случае сводится к растворению металла анода и выделению его на катоде. Схема электролиза
Электролиз может происходить только при определенной разности потенциалов, называемой потенциалом разложения. Потенциал разложения - минимально необходимая разность потенциалов, при которой начинается электролиз данного соединения.
Законы электролиза
С количественной стороны процесс электролиза был впервые изучен в тридцатых годах XIX века английским физиком Майклом Фарадеем (1791-1867), который установил два закона электролиза: 1. Масса образующегося при электролизе вещества пропорциональна количеству электричества прошедшего через раствор или расплав электролита; 2. При электролизе различных химических соединений равные количества электричества приводят к образованию на электродах эквивалентных количеств разных веществ. Для выделения при электролизе одного эквивалента вещества необходимо затратить 96500 кулонов. Величина 96500 Кл/моль называется постоянной Фарадея (F). Так при пропускании 96500 кулонов электричества через раствор CuCℓ2 на катоде выделяется один моль-эквивалента меди (31,77 г) и одновременно на аноде выделяется одна молярная масса эквивалента хлора (35,45 г). Законы Фарадея можно выразить уравнением m= МэIt/F = МэIt/96500 или V = VэIt/F = VэIt/96500, где m(V) –масса (объем) окисленного или восстановленного вещества, г (дм3); Мэ (Vэ) - молярная масса (объем эквивалента), г/моль (дм3); I - сила тока, А; t - продолжительность электролиза, с. Если It = 1 Кл, то масса выделившегося вещества составит Мэ/F = Е. Величина Е называется электрохимическим эквивалентом вещества окисляющегося или восстанавливающегося на электродах при прохождении через электролит 1 Кл электричества. Масса эквивалента связана с электрохимическим эквивалентом Мэ=ЕF. При практическом проведении электролиза расход тока превышает количество его, рассчитанное согласно закону Фарадея. Происходит это вследствие протекания тех или иных побочных процессов, поэтому в электрохимии используют понятие выход по току (η, % ). Выход по току отношение массы полученного веществ(mпракт) к массе, теоретически вычисленной (mтеoр) η = (mпракт/mтеор)100%
Поиск по сайту: |