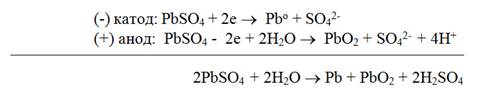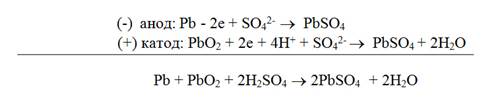|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Гальванические элементы, их электродвижущая сила
Два металла, погруженные в растворы своих солей, соединенные проводником, образуют гальванический элемент. Первый гальванический элемент был изобретен Александром Вольтом в 1800 г. Элемент состоял из медных и цинковых пластинок, разделенных сукном, смоченным раствором серной кислоты. При последовательном соединении большого числа пластинок элемент Вольта обладает значительной электродвижущей силой (э.д.с.). Возникновение электрического тока в гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается химическими превращениями, протекающими на электродах. Рассмотрим работу гальванического элемента на примере медно-цинкового элемента (Дж. Даниэля – Б.С. Якоби).
Схема медно-цинкового гальванического элемента Даниэля-Якоби
На цинковом электроде, опущенном в раствор сульфата цинка (с = 1 моль/дм3), происходит окисление цинка (растворение цинка) Znо - 2e = Zn2+. Электроны поступают во внешнюю цепь. Zn – источник электронов. Источник электронов принято считать отрицательным электродом – анодом. На электроде из меди, погруженном в раствор сульфата меди (с = 1 моль/дм3) происходит восстановление ионов металла. Атомы меди осаждаются на электроде Cu2+ + 2e = Cuо. Медный электрод положительный. Он является катодом. Одновременно часть ионов SO42- переходят через солевой мостик в сосуд с раствором ZnSO4. Сложив уравнения процессов, протекающих на аноде и катоде, получим суммарное уравнение
или в молекулярной форме
Это обычная окислительно - восстановительная реакция, протекающая на границе металл-раствор. Электрическая энергия гальванического элемента получается за счёт химической реакции. Рассмотренный гальванический элемент можно записать в виде краткой электрохимической схемы (-) Zn/Zn2+//Cu2+/Cu (+). Необходимым условием работы гальванического элемента является разность потенциалов, она называется электродвижущей силой гальванического элемента (э.д.с.). Э.д.с. всякого работающего гальванического элемента величина положительная. Для вычисления э.д.с. гальванического элемента надо из величины более положительного потенциала отнять величину менее положительного потенциала. Так э.д.с. медно–цинкового гальванического элемента при стандартных условиях (t = 25 оС, с = 1 моль/дм3, Р = 1 атм ) равна разности между стандартными электродными потенциалами меди (катода) и цинка (анода), то есть э.д.с. = ЕоСu2+/Cu - ЕoZn2+/Zn= +0,34 В – (-0,76 В) = +1,10 В.
В паре с цинком ион Cu2+ восстанавливается. Необходимую для работы разность электродных потенциалов можно создать, используя один и тот же раствор разной концентрации и одинаковые электроды. Такой гальванический элемент называется концентрационным, а работает он за счет выравнивания концентраций раствора. Примером может служить элемент, составленный из двух водородных электродов Pt, H2 / H2SO4 (с`) // H2SO4 (с``) /H2, Pt, где с` = [H+]`; с`` = [H+]``. Если р = 101 кПа, с` < с``, то его э.д.с. при 25 оС определяется уравнением Е = 0,059lg(с``/с`). При с` = 1 моль-ион/дм3 э.д.с. элемента определяется концентрацией водородных ионов во втором растворе, то есть Е = 0,059lgс`` = -0,059 pH. Определение концентрации ионов водорода и, следовательно, рН среды измерением э.д.с. соответствующего гальванического элемента называется потенциометрией. Аккумуляторы
Аккумулятораминазываются гальванические элементы многоразового и обратимого действия. Они способны превращать накопленную химическую энергию в электрическую при разрядке, а электрическую в химическую, создавая запас ее в процессе зарядки. Так как э.д.с. аккумуляторов невелика, при эксплуатации их обычно соединяют в батареи. Свинцовый аккумулятор. Свинцовый аккумулятор состоит из двух перфорированных свинцовых пластин, одна из которых (отрицательная) после зарядки содержит наполнитель - губчатый активный свинец, а другая ( положительная) - диоксид свинца. Обе пластины погружены в 25 - 30 % раствор серной кислоты (рис. 35). Схема аккумулятора (-) Pb/ p -p H2SO4/ PbO2/Pb(+). Перед зарядкой в поры свинцовых электродов вмазывается паста, содержащая помимо органического связующего оксид свинца PbO. В результате взаимодействия оксида свинца с серной кислотой в порах электродных пластин образуется сульфат свинца PbО + H2SO4 = PbSO4+ H2O. Аккумуляторы заряжают, пропуская электрический ток
Процесс разрядки
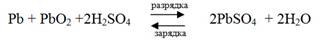
Суммарно процессы, происходящие при зарядке и разрядке аккумулятора, можно представить следующим образом
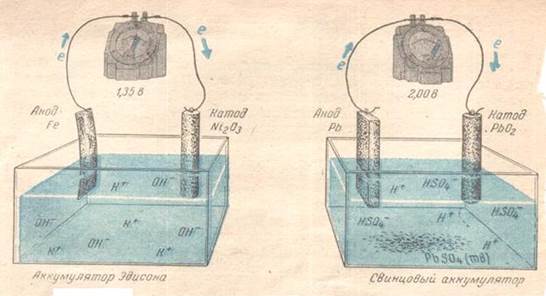
При зарядке аккумулятора плотность электролита (серной кислоты) увеличивается, а при разрядке уменьшается. По плотности электролита судят о степени разряженности аккумулятора. Э.д.с. свинцового аккумулятора 2,1 В. Преимущества свинцового аккумулятора - большая электрическая емкость, устойчивость в работе, большое количество циклов (разрядка- зарядка). Недостатки - большая масса и, следовательно, малая удельная ёмкость, выделение водорода при зарядке, не герметичность при наличии концентрированного раствора серной кислоты. В этом отношении лучше щелочные аккумуляторы. Щелочные аккумуляторы.К ним относятся кадмиево-никеливые и железо-никелиевые аккумуляторы Т. Эдисона.
Схемы аккумулятора Эдисона и свинцового аккумулятора
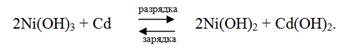
Они сходны между собой. Различие состоит в материале пластин отрицательного электрода. В первом случае они кадмиевые, во втором железные. Электролитом служит раствор КОН ω = 20 %. Наибольшее практическое значение имеют кадмиево-никелевые аккумуляторы. Схема кадмиево-никелевого аккумулятора (-) Cd / раствор KOH /Ni2O3/Ni (+). Работа кадмиевого-никелевого аккумулятора основана на окислительно-восстановительной реакции с участием Ni3+
Э.д.с. заряженного кадмиево-никелевого аккумулятора составляет 1.4 В. В таблице представлены характеристики аккумулятора Эдисона и свинцового аккумулятора.
Поиск по сайту: |