 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Электропроводные потенциалыСтр 1 из 4Следующая ⇒
Электрический ток в электролитах. Эл. током назыв. растворы, в которых растворённое в-во разделяется на составные части при протекании через них эл. тока. Эл. ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей кислот и щелочей в результате расщепления части нейтральных молекул. Рекомбинация происходит главным образом в ионизованных газах и плазме и приводит к практически полному исчезновению заряженных частиц при отсутствии противодействующих ей факторов. Процесс расщепления молекул растворяемых в-в на ионы в результате взаимодействия с растворителем назыв. электролитической диссоциацией. З-н Освальда: соотношение выражающее зависимость эквивалентной электропроводности разбавленного раствора слабого электролита от концентрации раствора Коэффициент эл. диссоциации: Проводимость электролитов:
Электролиз. При прохождение тока через электроны на электродах, которые служат для подачи напряжения, выделяются продукты электрохимической реакции, т.е. наблюдается явление электролиза. 1 з-н Фарадея гласит, что масса выделившегося на электроде в-ва прямо пропорциональна прошедшему через электроны заряду, т.е m=kq, где k-электрохимический эквивалент в-ва. 2 з-н Фарадея утверждает, что электрохимические эквиваленты в-ва пропорциональны их химическим эквивалентам.
Электропроводные потенциалы. Электродный потенциал – разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Химические источники тока: аккумуляторы, топливные элементы, воздушно-цинковый элемент. Химический источник тока – такой источник тока, в котором энергия протекающих в нём химических реакций, непосредственно превращается в электрическую энергию. Основу химических источников составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов – электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
Поиск по сайту: |

 (пар. ионов/раствора).
(пар. ионов/раствора). где z-валентность метала.
где z-валентность метала.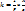 , где А-атомная масса, z-его валентность, F-постоянная Фарадея.
, где А-атомная масса, z-его валентность, F-постоянная Фарадея.
 объединённый з-н Фарадея.
объединённый з-н Фарадея.